
| A. | W、M的離子半徑為M<W | |
| B. | YZ2為直線形的共價化合物,W2Z2既含有離子鍵又含有共價鍵 | |
| C. | Z與X形成的化合物的熔沸點偏高是因其分子內存在氫鍵 | |
| D. | Z與M形成的化合物可作為耐高溫材料 |
分析 X、Y、Z、W、M為原子序數依次增大的短周期主族元素.
由①元素對應的原子半徑大小為:X<Z<Y<M<W;
②Y是組成有機物的必要元素,則Y為C元素;
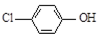
③Z與X可形成兩種常見的共價化合物,與W可形成兩種常見的離子化合物,Z與X可形成H2O、H2O2兩種共價化合物,Z與W可形成Na2O、Na2O2兩種常見的離子化合物,則X為H,Z為O,W為Na;
④M的電子層數與最外層電子數相等,結合原子序數可知,M為第三周期第ⅢA族元素,為Al,以此來解答.
解答 解:由上述分析可知,X為H,Y為C,Z為O,W為Na,M為Al,
A.具有相同電子排布的離子中,原子序數大的離子半徑小,則W、M的離子半徑為M<W,故A正確;
B.CO2為直線形的共價化合物,Na2O2既含有離子鍵、O-O共價鍵,故B正確;
C.Z與X形成的化合物為水,分子間含氫鍵,則沸點高,故C錯誤;
D.Z與M形成的化合物為氧化鋁,熔點高,可作為耐高溫材料,故D正確;
故選C.
點評 本題考查原子結構與元素周期律,為高考常見題型和高頻考點,把握原子序數、原子半徑、元素化合物知識推斷元素為解答的關鍵,側重分析與應用能力的考查,注意規律性知識的應用,題目難度不大.


科目:高中化學 來源: 題型:解答題
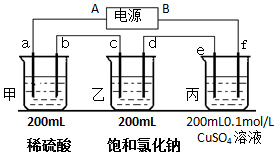 用上面的電池對下物質進行電解,其中a、b、c、d、e、f電極均為惰性電極,通電后,a極產生的氣體明顯多于b極,2分鐘后,測得乙池的pH為12,則
用上面的電池對下物質進行電解,其中a、b、c、d、e、f電極均為惰性電極,通電后,a極產生的氣體明顯多于b極,2分鐘后,測得乙池的pH為12,則查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ),同時利用此裝置的電能在鐵上鍍銅,下列說法正確的是( )
),同時利用此裝置的電能在鐵上鍍銅,下列說法正確的是( )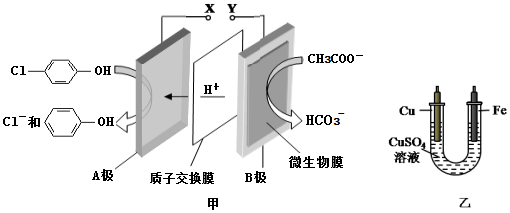
| A. | 當外電路中有0.2 mole-轉移時,A極區增加的H+的個數為0.1 NA | |
| B. | A極的電極反應式為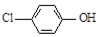 +e-=Cl-+ +e-=Cl-+ | |
| C. | 鐵電極應與Y相連接 | |
| D. | 反應過程中甲中右邊區域溶液pH逐漸升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗 | 操作 | |
| A | 除去NaHCO3固體中混有的NH4Cl | 直接將固體加熱 |
| B | 實驗室收集Cu與稀硝酸反應成的NO | 向上排空氣法收集 |
| C | 檢驗乙酸具有酸性 | 配制乙酸溶液,滴加NaHCO3溶液有氣泡產生 |
| D | 測定某稀硫酸的濃度 | 取20.00ml該稀硫酸于干凈的錐形瓶中,用 0.1000mol/L的NaOH標準液進行滴定 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
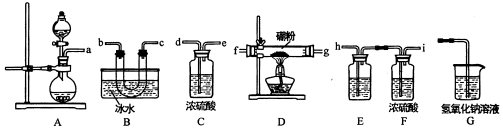
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
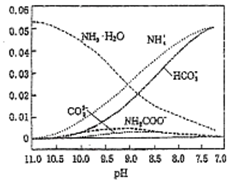 40℃,在氨-水體系中不斷通入CO2,各種離子物質的量濃度隨pH的變化趨勢如圖所示.下列說法正確的是( )
40℃,在氨-水體系中不斷通入CO2,各種離子物質的量濃度隨pH的變化趨勢如圖所示.下列說法正確的是( )| A. | 由圖中數據可計算NH4+的水解平衡常數約為1×10-9 | |
| B. | 不同pH的溶液中存在關系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 隨著CO2的通入,$\frac{[O{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$不斷增大 | |
| D. | 由圖可得離子的水解能力NH4+>HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Z的濃度可能為0.3mol/L | |
| B. | 平衡時X2、Y2的轉化率相等 | |
| C. | 平衡時,Y2和Z的生成速率之比為2:1 | |
| D. | 若平衡后再改變外界條件,升高溫度,則反應的平衡常數將變大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | .硅酸三鈣 | B. | .碳酸二鈣 | C. | 鋁酸三鈣 | D. | .碳酸鈣 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com