
 已知A、B、C、D、E、F六種元素的原子序數依次遞增,都位于前四周期.A位于周期表的s區,其原子中電子層數和未成對電子數相同;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同;D原子的核外成對電子數是未成對電子數的3倍.E有“生物金屬”之稱,E4+離子和氬原子的核外電子排布相同.F處于周期表中第9列.
已知A、B、C、D、E、F六種元素的原子序數依次遞增,都位于前四周期.A位于周期表的s區,其原子中電子層數和未成對電子數相同;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同;D原子的核外成對電子數是未成對電子數的3倍.E有“生物金屬”之稱,E4+離子和氬原子的核外電子排布相同.F處于周期表中第9列.分析 A、B、C、D、E、F六種元素的原子序數依次遞增,都位于前四周期.A位于周期表的s區,其原子中電子層數和未成對電子數相同,則A為H元素;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同,核外電子排布為1s22s22p2,則B為碳元素;D原子的核外成對電子數是未成對電子數的3倍,核外電子排布為1s22s22p4,則D為O元素;C的原子序數介于碳、氧之間,故C為N元素;E有“生物金屬”之稱,E4+離子和氬原子的核外電子排布相同,則E的原子序數為18+4=22,故E為Ti;F處于周期表中第9列,且為第四周期元素,故F為Co,據此解答.
解答 解:A、B、C、D、E、F六種元素的原子序數依次遞增,都位于前四周期.A位于周期表的s區,其原子中電子層數和未成對電子數相同,則A為H元素;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同,核外電子排布為1s22s22p2,則B為碳元素;D原子的核外成對電子數是未成對電子數的3倍,核外電子排布為1s22s22p4,則D為O元素;E有“生物金屬”之稱,E4+離子和氬原子的核外電子排布相同,則E的原子序數為18+4=22,故E為Ti;F處于周期表中第9列,且為第四周期元素,故F為Co.
(1)B、C、D三種元素的氫化物分別CH4、NH3、H2O,常溫下H2O為液態,而CH4、NH3為氣體,H2O的沸點最高,由于NH3分子之間存在氫鍵,其沸點高于CH4,故沸點高低順序為CH4<NH3<H2O,由于非金屬性:C<N<O,故穩定性順序為:CH4<NH3<H2O,
故答案為:CH4<NH3<H2O;CH4<NH3<H2O;
(2)同時含有H、C、O三種元素的化合物M是此類物質中為數不多的氣體,且分子中所有原子共平面,則M為HCHO,結構式為 ,分子中σ鍵和π鍵個數比為3:1,碳原子的雜化類型為sp2雜化,由于甲醛能和水分子間形成氫鍵,能和水以任意比混溶,
,分子中σ鍵和π鍵個數比為3:1,碳原子的雜化類型為sp2雜化,由于甲醛能和水分子間形成氫鍵,能和水以任意比混溶,
故答案為:3:1;sp2;甲醛能和水分子間形成氫鍵;
(3)C的最高價含氧酸根為NO3-,N原子孤電子對數為$\frac{5+1-2×3}{2}$=0,價層電子對數為3+0=3,故NO3-的空間構型為平面三角形,E為Ti,原子核外有22個電子,基態原子的價電子排布式為3d24s2,
故答案為:平面三角形;3d24s2;
(4)以頂點Ti原子研究,與之最近的Ti原子處于面心,每個頂點為8個晶胞共用,每個面心為2個晶胞共用,則晶胞中Ti的配位數為$\frac{8×3}{2}$=12,晶胞中Ti原子數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,則晶胞質量為4×$\frac{M}{{N}_{A}}$g,則晶胞體積為:4×$\frac{M}{{N}_{A}}$g÷a g/cm3=$\frac{4M}{a{N}_{A}}$cm3,故晶胞棱長為$\root{3}{\frac{4M}{a{N}_{A}}}$cm,則Ti原子的半徑為$\root{3}{\frac{4M}{a{N}_{A}}}$cm×$\sqrt{2}$×$\frac{1}{4}$=$\frac{\sqrt{2}}{4}×\root{3}{\frac{4M}{a{N}_{A}}}$cm,
故答案為:12;$\frac{\sqrt{2}}{4}×\root{3}{\frac{4M}{a{N}_{A}}}$;
(5)Co可形成分子式均為Co(NH3)5BrSO4的兩種配合物,其中一種化學式為[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液時,硫酸根離子處于外界,會生成BaSO4沉淀,產生的現象是:產生白色沉淀;
往另一種配合物的溶液中加入BaCl2溶液時,無明顯現象,則硫酸根處于內界,若加入AgNO3溶液時,產生淡黃色沉淀,則溴離子處于外界,則第二種配合物的化學式為:[Co(SO4)(NH3)5]Br,
故答案為:產生白色沉淀;[Co(SO4)(NH3)5]Br.
點評 本題是對物質結構與性質的考查,涉及核外電子排布、元素周期律、化學鍵、氫鍵、雜化方式、微粒構型、晶胞計算、配合物等知識點,題目比較綜合,推斷元素是解題關鍵,需要學生具備扎實的基礎與靈活運用的能力,難度中等.


 提分百分百檢測卷系列答案
提分百分百檢測卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 10g NaOH固體溶解在水中配成250mL溶液 | |
| B. | 將80g SO3溶于水并配成1L的溶液 | |
| C. | 將100mL濃度為0.5mol/L的NaNO3溶液加熱蒸發50克水 | |
| D. | 標況下,將22.4L氯化氫氣體溶于水配成1L溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 苯甲酸廣泛用于醫藥、食品、染料、化工等領域.以下是實驗室制備苯甲酸的一種方法.反應原理如下:
苯甲酸廣泛用于醫藥、食品、染料、化工等領域.以下是實驗室制備苯甲酸的一種方法.反應原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O +HCl→
+HCl→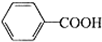 ↓+KCl
↓+KCl| 名稱 | 相對分子質量 | 性狀 | 熔點/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 無色液體易燃易揮發 | -96 | 不溶 | 易容 |
| 苯甲酸 | 122 | 白色片狀或針狀晶體 | 122.4 (100℃升華) | 25℃0.35g 80℃2.7g | 易容 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| X | Y | Z | M | R | Q | |
| 原子半徑/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合價 | -4,+4 | -2 | -1,+7 | +3 | ||
其它 | 陽離子核外無電子 | 可做半導體材料 | 焰色反應呈黃色 |
 ,R在自然界中有質量數為35和37的兩種核素,它們之間的關系互為同位素.
,R在自然界中有質量數為35和37的兩種核素,它們之間的關系互為同位素.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鐵是最常見的金屬材料.鐵能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合鐵(Ⅲ)]和Fe(CO)x等多種配合物.
鐵是最常見的金屬材料.鐵能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合鐵(Ⅲ)]和Fe(CO)x等多種配合物.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 如圖1所示是硫酸的試劑標簽上的部分內容.某次學生實驗需要0.5mol•L-1 H2SO4溶液480mL,若由你來配制所需溶液,請根據實驗室已有的儀器和藥品情況回答下列問題:
如圖1所示是硫酸的試劑標簽上的部分內容.某次學生實驗需要0.5mol•L-1 H2SO4溶液480mL,若由你來配制所需溶液,請根據實驗室已有的儀器和藥品情況回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com