
| 實驗組序 | 溫度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
分析 (1)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
根據蓋斯定律知,①+②×,①+②×$\frac{1}{2}$-③得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l);
(2)①利用三段式求得500℃時的平衡常數K,根據題中數據求得Qc的值,根據K與Qc判斷反應方向,根據轉化率=$\frac{已轉化的量}{起始量}$×100%計算;
②根據K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}(H{\;}_{2})}$計算;
③750℃恒壓條件十,達到平衡時CO的體積分數為W%,即與原平衡為成比例的等效平衡,將生成物折算成反應后,各反應物的物質的量之比相等可;
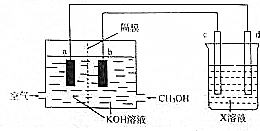
(3)在甲醇燃料電池中,甲醇是還原劑,在電池的負極反應,生成碳酸根離子,氧氣是氧化劑,在正極發生還原反應,生成氫氧根離子,根據裝置圖可知,b極為負極,a為正極,所以d為陽極,c為陰極,電解精煉銅時用粗銅作陽極,用硫酸銅溶液作電解質溶液,據此答題;
解答 解:(1)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
根據蓋斯定律知,①+②×$\frac{1}{2}$-③得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-571.6kJ•mol-1-566.0kJ•mol-1×$\frac{1}{2}$+90.8kJ•mol-1=-763.8kJ•mol-1,所以甲醇蒸汽燃燒熱的熱化學方程式為CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-763.8kJ•mol-1 ,
故答案為:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-763.8kJ•mol-1 ;
(2)①利用三段式,根據題中數據有,
CO(g)+2H2(g)=CH3OH(g)
起始(mol/L) 1 2 0
轉化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 1 0.5
所以平衡常數K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}(H{\;}_{2})}$=$\frac{0.5}{0.5×{1}^{2}}$=1,根據題中數據實驗2中,Qc=$\frac{0.3}{1.{4}^{2}×0.7}$=0.22<1,所以反應向正反應方向進行,CO的轉化率為=$\frac{0.5}{1}$×100%=50%,
故答案為:正;50%;
②利用三段式,根據題中數據有750℃時,
CO(g)+2H2(g)=CH3OH(g)
起始(mol/L) 0 0 1
轉化(mol/L) 0.4 0.8 0.4
平衡(mol/L) 0.4 0.8 0.4
所以平衡常數K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}(H{\;}_{2})}$=$\frac{0.4}{0.{8}^{2}×0.4}$=1.56,
故答案為:1.56;
③利用三段式,根據題中數據有750℃時,
CO(g)+2H2(g)=CH3OH(g)
起始1(mol/L) 0.4 0.8 0.6
折算后(mol/L) 1 2 0
起始2(mol/L) x y 0
所以有x:y=1:2,
故答案為:x:y=1:2;
(3)在甲醇燃料電池中,甲醇是還原劑,在電池的負極反應,生成碳酸根離子,氧氣是氧化劑,在正極發生還原反應,生成氫氧根離子,根據裝置圖可知,b極為負極,a為正極,所以d為陽極,c為陰極,電解精煉銅時用粗銅作陽極,用硫酸銅溶液作電解質溶液,
①根據上面的分析可知,應選粗銅作d電極的電極材料,C電極的名稱為陰極,X溶液為 硫酸銅溶液,
故答案為:粗銅;陰;硫酸銅;
②b電極為甲醇發生氧化反應,生成碳酸根離子,電極反應式為CH3OH-6e-+8OH-=CO32-+6H2O,
故答案為:CH3OH-6e-+8OH-=CO32-+6H2O;
③電解精煉過程中a電極上氧氣是氧化劑,在正極發生還原反應,生成氫氧根離子,所以溶液的溶液的pH會增大,
故答案為:增大.
點評 本題考查化學平衡的標志、平衡常數的計算及化學平衡移動原理、蓋斯定律的計算應用等,知識點較多,綜合性很強,難度中等.


 名師伴你成長課時同步學練測系列答案
名師伴你成長課時同步學練測系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 L 0.1 mol•L-1的CuCl2溶液中含Cu2+為0.1NA | |
| B. | 標準狀況下,22.4 L CCl4含CCl4分子為NA | |
| C. | 1mol H3O+含質子數為10 NA | |
| D. | 1mol Na2O2混合物中含陰離子的數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
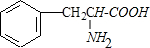 .
.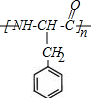 .
.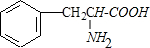 $→_{△}^{催化劑}$
$→_{△}^{催化劑}$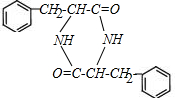 +2H2O;M與乙醇在濃硫酸、加熱條件下發生反應的類型為酯化反應(取代反應).
+2H2O;M與乙醇在濃硫酸、加熱條件下發生反應的類型為酯化反應(取代反應).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+NaCO3═CaCO3↓+NaNO3 | |
| D. | H++OH-═H2O 2KOH+H2SO4═K2SO4+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 苯(甲苯):加酸性高錳酸鉀溶液、再加NaOH溶液,分液 | |
| B. | 乙烷(乙烯),催化條件下通入H2 | |
| C. | 乙酸(乙醛),加入新制氫氧化銅,蒸餾 | |
| D. | 乙醛(乙酸),加入氫氧化鈉溶液洗滌,蒸餾 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com