
分析 (1)氨氣溶液水生成一水合氨,二氧化碳與一水合氨反應生成碳酸氫銨,氯化鈉與碳酸氫銨反應生成氯化銨和碳酸氫鈉;
(2)析出小蘇打的母液中含有氯化銨,加入生石灰后,生石灰與水反應生成氫氧化鈣,氫氧化鈣與氯化銨反應生成氨氣;
(3)碳酸氫鈉不穩定,受熱分解生成碳酸鈉、水和二氧化碳;
(4)分析比較兩種制備流程,結合反應生成產物比較異同,從副產物的主要作用和原料利用等分析比較.
解答 解:(1)氨化的飽和NaCI溶液中通過入CO2,反應生成碳酸氫鈉和氯化銨,方程式為:CO2+NH3+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
故答案為:CO2+NH3+H2O=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
(2)析出小蘇打的母液中含有氯化銨和碳酸氫鈉,加入生石灰后,生石灰與水反應生成氫氧化鈣,碳酸氫鈉溶液與氫氧化鈣反應生成碳酸鈣沉淀,氫氧化鈣與氯化銨反應生成氨氣,發生的化學方程式為:CaO+H2O=Ca(OH)2、NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O、2NH4Cl+Ca(OH)2$\frac{\underline{\;加熱\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案為:CaO+H2O=Ca(OH)2、NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O、2NH4Cl+Ca(OH)2$\frac{\underline{\;加熱\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)碳酸氫鈉受熱分解的化學方程式為2NaHCO3$\frac{\underline{\;加熱\;}}{\;}$Na2CO3+H2O+CO2↑,故答案為:2NaHCO3$\frac{\underline{\;加熱\;}}{\;}$Na2CO3+H2O+CO2↑;
(4)索爾維法缺點:大量CaCl2用途不大,NaCl利用率只有70%,約有30%的NaCl留在母液中;
侯氏制堿法的優點:把合成氨和純堿兩種產品聯合生產,提高了食鹽利用率,縮短了生產流程,減少了對環境的污染,降低了純堿的成本.保留了氨堿法的優點,消除了它的缺點,使食鹽的利用率提高到96%;NH4Cl可做氮肥;可與合成氨廠聯合,使合成氨的原料氣CO轉化成CO2,減少無用的氯化鈣生成;
故答案為:使NH4Cl析出,可做氮肥;減少無用的CaCl2生成,原料NaCl充分利用.
點評 本題考查了純堿的制備原理分析比較,明確物質的性質和生產原理是解題關鍵,題目難度中等.


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:多選題
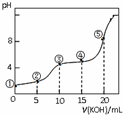 常溫下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲線如圖(體積變化忽略不計).下列說法錯誤的是( )
常溫下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲線如圖(體積變化忽略不計).下列說法錯誤的是( )| A. | 點②溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| B. | 點③溶液中:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) | |
| C. | 點④溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05 mol•L-1 | |
| D. | 點⑤溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
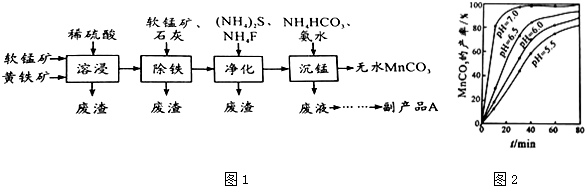
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AlCl3溶液中加入過量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 在海帶灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+═I2+O2↑+2H2O | |
| C. | 在氫氧化鋇溶液中滴加硫酸氫鉀溶液至PH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 用碳酸鈉溶液浸泡鍋爐水垢:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
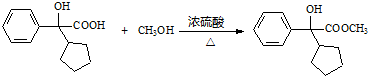 .
.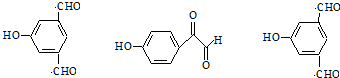 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ② | C. | ①② | D. | ②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗組序 | 溫度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
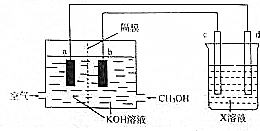
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com