
| A. | 方框中的物質應為 Cu2S | |
| B. | 若有1 molSO2生成,則反應中有4 mol 電子轉移 | |
| C. | SO2既是氧化產物又是還原產物 | |
| D. | O2只作氧化劑 |
分析 在2CuFeS2+O2= +2FeS+SO2中,先由質量守恒推斷方框中的物質,再由Cu元素的化合價降低,O元素的化合價降低,S元素的化合價升高,以此來解答.
+2FeS+SO2中,先由質量守恒推斷方框中的物質,再由Cu元素的化合價降低,O元素的化合價降低,S元素的化合價升高,以此來解答.
解答 解:A.由質量守恒定律可知,Cu、S原子守恒,則方框中的物質應為Cu2S,故A正確;
B.2CuFeS2+O2=Cu2S+2FeS+SO2反應中化合價升高的只有S元素,從-2價升高到+4價,若有1molSO2生成,則反應中轉移的電子為1mol×(4-(-2))=6mol,故B錯誤;
C.S元素由-1價升高到+4價,O元素0價降低為-2價,則SO2既是氧化產物又是還原產物,故C正確;
D.反應中O元素的化合價降低,則O2只作氧化劑,故D正確;
故選B.
點評 本題考查氧化還原反應,明確元素的化合價是解答本題的關鍵,準確判斷CuFeS2中是學生解答在的難點和易錯點,難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在SiO2晶體中,1個Si原子和2個O原子形成2個共價鍵 | |
| B. | NF3的沸點比NH3的沸點低得多,是因為NH3分子間有氫鍵,NF3分子間只有范德華力 | |
| C. | NCl3和BCl3分子中,中心原子都采用sp3雜化 | |
| D. | SO3與CO32-互為等電子體,SO3是極性分子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2OH+CH3COOH$→_{△}^{催化劑}$ CH3COOCH2CH3+H2O | |
| B. | 2CH3CHO+O2 $→_{△}^{催化劑}$2CH3COOH | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. |  +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$ -Br+HBr -Br+HBr |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe3+、NH4+、SCN-、C1- | B. | Na+、Br-、NH4+、SO42- | ||
| C. | Na+、HCO3-、K+、CO32- | D. | Fe2+、NH4+、C1-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
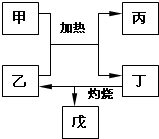 有關元素X、Y、Z、D、E的信息如表
有關元素X、Y、Z、D、E的信息如表| 元素 | 有關信息 |
| X | 元素主要化合價為-2,原子半徑為0.074nm |
| Y | 所在主族序數與所在周期序數之差為4 |
| Z | 原子半徑為0.102nm,其單質在X的單質中燃燒,發出明亮的藍紫色火焰 |
| D | 最高價氧化物既能溶于強酸又能溶于強堿 |
| E | 單質是生活中常見金屬,其制品在潮濕空氣中易被腐蝕或損壞 |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
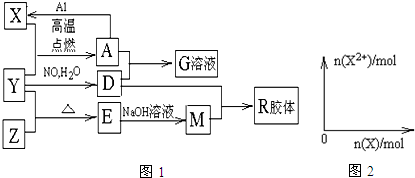
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
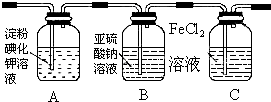
| 實驗步驟 | 預期現象和結論 |
| 步驟1:取適量洗氣瓶B中溶液于試管A中,滴加過量2 mol/LHCl和1 mol/LBaCl2溶液,振蕩. | 若產生的白色沉淀,則洗氣瓶B溶液中存在SO42-. |
| 步驟2:另取適量洗氣瓶B中溶液于試管B中,滴加過量l mol/LBa(NO3)2溶液,振蕩,靜置. | 產生白色沉淀. |
| 步驟3:取步驟2后試管B中的上層清液于試管C中,滴加0.1mol/LAgNO3溶液和過量的2mol/LHNO3,振蕩. | 若產生白色沉淀,則洗氣瓶B溶液中存在Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HAt很穩定 | B. | At是有色固體 | ||
| C. | At易溶于有機溶劑 | D. | AgAt不溶于水 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com