
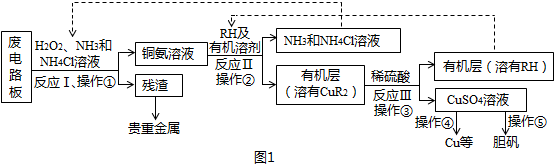
分析 廢電路板中加入H2O2、NH3、NH4Cl溶液,得到銅氨溶液和殘渣,分離難溶性固體和溶液采用過濾方法,所以操作①是過濾,反應Ⅰ是將Cu轉化為Cu(NH3)42+,Cu元素化合價由0價變為+2價,所以Cu是還原劑,則雙氧水是氧化劑,將Cu氧化;反應Ⅱ是銅氨溶液中的Cu(NH3)42+與有機物RH反應,生成CuR2,同時生成NH4+和NH3;
互不相溶的液體采用分液方法分離,所以操作②是分液;向有機層中加入稀硫酸,根據流程圖知,生成CuSO4和HR,然后采用分液方法分離得到HR,以石墨為電極電解CuSO4溶液時,陽極上OH-放電、陰極上Cu2+ 放電;從CuSO4溶液中獲取膽礬,采用加熱濃縮、冷卻結晶、過濾的方法得到晶體;
(1)雙氧水具有氧化性,能氧化還原性物質,分離難溶性固體和溶液采用過濾方法;
(2)反應Ⅱ是銅氨溶液中的Cu(NH3)42+與有機物RH反應生成CuR2,同時生成NH4+和NH3,根據反應物和生成物書寫該反應的離子方程式為;分離互不相溶的液體采用分液方法,分液時常用分液漏斗;
(3)反應Ⅲ是有機溶液中的CuR2與稀硫酸反應生成CuSO4和RH,分液時分液漏斗下端要緊靠燒杯內壁,且分液漏斗內不能盛放太多溶液;
(4)以石墨為電極電解硫酸銅溶液時,陽極上氫氧根離子放電、陰極上銅離子放電,SO42-向陽極移動;從溶液中獲取晶體采用加熱濃縮、冷卻結晶、過濾方法;
(5)電解硫酸銅溶液時能得到硫酸,硫酸能循環利用;氯化銨電離出的銨根離子抑制一水合氨電離而降低溶液堿性.
解答 解:廢電路板中加入H2O2、NH3、NH4Cl溶液,得到銅氨溶液和殘渣,分離難溶性固體和溶液采用過濾方法,所以操作①是過濾,反應Ⅰ是將Cu轉化為Cu(NH3)42+,Cu元素化合價由0價變為+2價,所以Cu是還原劑,則雙氧水是氧化劑,將Cu氧化;反應Ⅱ是銅氨溶液中的Cu(NH3)42+與有機物RH反應,生成CuR2,同時生成NH4+和NH3;
互不相溶的液體采用分液方法分離,所以操作②是分液;向有機層中加入稀硫酸,根據流程圖知,生成CuSO4和HR,然后采用分液方法分離得到HR,以石墨為電極電解CuSO4溶液時,陽極上OH-放電、陰極上Cu2+ 放電;從CuSO4溶液中獲取膽礬,采用加熱濃縮、冷卻結晶、過濾的方法得到晶體;
(1)雙氧水具有氧化性,能氧化還原性物質Cu,所以雙氧水作氧化劑;分離難溶性固體和溶液采用過濾方法,該混合溶液中貴重金屬是難溶物、銅氨溶液是液體,所以操作①是過濾,
故答案為:氧化劑;過濾;
(2)反應Ⅱ是銅氨溶液中的Cu(NH3)42+與有機物RH反應生成CuR2,同時生成NH4+和NH3,根據反應物和生成物書寫該反應的離子方程式Cu(NH3)42++2RH=CuR2+2NH4++2NH3↑;分離互不相溶的液體采用分液方法,分液時常用分液漏斗,分液的目的是富集銅元素、使銅元素與水溶液中的物質分離,所以ab正確,
故答案為:Cu(NH3)42++2RH=CuR2+2NH4++2NH3↑;分液漏斗;ab;
(3)反應Ⅲ是有機溶液中的CuR2與稀硫酸反應相當于復分解反應,所以生成CuSO4和RH,分液時分液漏斗下端要緊靠燒杯內壁,且分液漏斗內不能盛放太多溶液,
故答案為:RH;分液漏斗尖端未緊靠燒杯內壁;液體過多;
(4)以石墨為電極電解硫酸銅溶液時,陽極上氫氧根離子放電、陰極上銅離子放電,所以陽極上生成O2,同時有大量的H+生成,且SO42-也向陽極移動在陽極積累,因此陽極產物還有H2SO4;從溶液中獲取晶體采用加熱濃縮、冷卻結晶、過濾方法,
故答案為:O2、H2SO4;加熱濃縮、冷卻結晶、過濾;
(5)電解硫酸銅溶液時能得到硫酸,在反應III中用到硫酸,所以H2SO4能循環利用;氯化銨電離出的銨根離子抑制一水合氨電離而降低溶液堿性,從而抑制氫氧化銅生成,
故答案為:H2SO4;防止由于溶液中c(OH-)過高,生成Cu(OH)2沉淀.
點評 本題為2015年高考題,考查物質分離和提純,涉及基本實驗操作、氧化還原反應、電解原理等知識點,側重考查學生實驗操作規范性、知識綜合應用能力等,明確化學原理及基本操作原理是解本題關鍵,易錯點是硫酸是否能循環利用的判斷.


科目:高中化學 來源: 題型:選擇題
| A. | 在溶液中加KSCN,溶液顯紅色,證明原溶液中有Fe3+,無Fe2+ | |
| B. | 灼燒白色粉末,火焰成黃色,證明原粉末中有Na+,無K+ | |
| C. | 氣體通過無水硫酸銅,粉末變藍,證明原氣體中含有水蒸氣 | |
| D. | 將氣體通入澄清石灰水,溶液變渾濁,證明原氣體是CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用加熱法除去NaOH固體中混有的NH4Cl固體. | |
| B. | 向Al2(SO4)3溶液中滴加過量的NaOH溶液制備Al(OH)3 | |
| C. | SO2能使酸性KMnO4溶液褪色,說明SO2具有漂白性 | |
| D. | 向水玻璃中滴加鹽酸制備硅酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
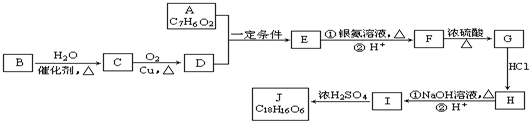
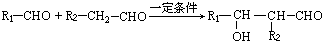
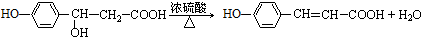
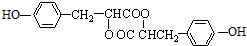 .
.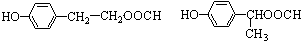 任意一種.
任意一種.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
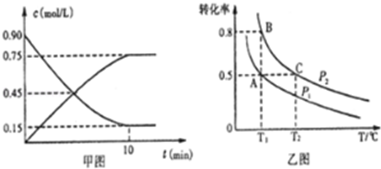
| 溫度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡轉化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 運用化學原理知識研究化學對于人類的生產生活、科研意義重大.
運用化學原理知識研究化學對于人類的生產生活、科研意義重大.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Al→Al2O3→Al(OH)3→NaAl(OH)4 | ||
| C. | N2→NH3→NO→NO2→HNO3→NO2 | D. | S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com