
| A. | NaHB的電離方程式為:NaHB?Na-+H-+B2- | |
| B. | NaHB溶液一定呈酸性 | |
| C. | NaHB和NaOH溶液反應的離子方程式為H++OH-═H20 | |
| D. | NaHB溶液中一定存在:c(Na+)+c(H+)═c(HB-)+2c(B2-)+c(OH-) |
分析 據H2B在水溶液中的電離方程式可知,H2B為二元弱酸,
A、H2B為弱電解質,HB-不能拆開;
B、不知道HB-的電離程度與水解程度大小,無法判斷溶液酸堿性;
C、H2B為弱電解質,HB-不能拆開;
D、據電荷守恒分析.
解答 解:A、H2B為二元弱酸,NaHB的電離方程式為:NaHB?Na-+HB-,HB-?H-+B2-,故A錯誤;
B、HB-的電離程度大于水解程度時,溶液顯酸性,HB-的電離程度小于水解程度時,溶液顯堿性,故B錯誤;
C、NaHB和NaOH溶液反應的離子方程式為HB-+OH-═H20+B2-,故C錯誤;
D、在NaHB溶液中存在電荷守恒:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-),故D正確;
故選D.
點評 本題考查了溶液中的電荷守恒、弱電解質的電離,題目難度中等,注意掌握強弱電解質的概念及判斷方法,能夠根據電荷守恒、物料守恒、鹽的水解原理分析.


科目:高中化學 來源: 題型:選擇題
| A. | 鋇與水反應不如鈉與水反應劇烈 | B. | 鋇可以從KCl溶液中置換出鉀 | ||
| C. | Ba(OH)2可與NH4Cl反應,反應放熱 | D. | 堿性:KOH>Ba(OH)2>NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含有1molFe(OH)3的氫氧化鐵膠體中,含有NA個Fe(OH)3膠粒 | |
| B. | 1mol-L-1Na2CO3溶液100mL,含有0.1NA個CO32- | |
| C. | 足量的鐵與1molCl2充分反映轉移的電子數為3NA | |
| D. | 高溫常壓下,22.4L的一氯甲烷中含有的分子數小于NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
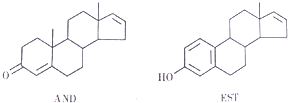
| A. | 這兩種分子均能與NaOH溶液反應 | |
| B. | AND和KST分別與足量氫氣加成后的兩種產物互為同系 | |
| C. | AMD和EST均瓸于芳香族化合物 | |
| D. | EST的M分丼構體中,有的結構中含有蔥環(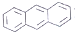 ) ) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
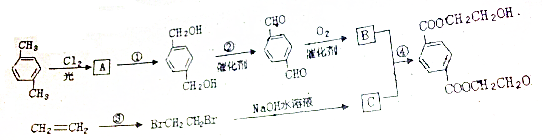
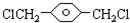 ,
,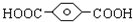 ,HOCH2CH2OH.
,HOCH2CH2OH.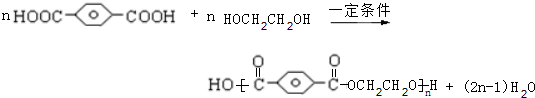 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將含0.1molFeCl3的溶液滴加到沸水中完全水解可生成0.1NA個Fe(OH)3膠粒 | |
| B. | 常溫常壓下,0.1molD216O中含中子數、質子數、電子數均為NA | |
| C. | 將0.1molCl2通入1L水中,轉移的電子數為0.1NA | |
| D. | 電解飽和食鹽水,當陰極產生1.12LH2時,轉移的電子數一定為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe和鹽酸反應:2Fe+6H+=2Fe3++3H2↑ | |
| B. | Cu和AgNO3溶液反應:Cu+Ag+=Cu2++Ag | |
| C. | 石灰石和鹽酸反應:CO32-+2H+=CO2↑+H2O | |
| D. | 氫氧化鋇與鹽酸反應:OH-+H+=H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| B. | 在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7 mol/L | |
| C. | 濃度均為0.1 mol/L的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| D. | 向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液達中性:則混合液體積V總≥20mL |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com