
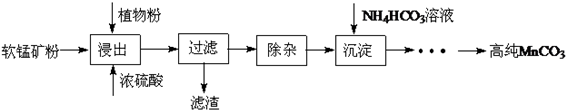
分析 濕法浸出軟錳礦(主要成分為MnO2,含少量Fe、Al、Mg等雜質元素)制備高純碳酸錳,加入濃硫酸和植物粉浸出過濾得到濾液除去雜質,加入碳酸氫銨形成沉淀通過一系列操作得到高純碳酸錳,
(1)產品碳酸錳中錳的化合價為+2價,可知加入植物粉是一種還原劑;
(2)使用碳酸錳調pH的優勢是不引入新的雜質;二氧化錳氧化過氧化氫為氧氣,本身被還原為錳離子;
(3)依據碳酸氫銨受熱易分解分析,在30℃~35℃下,將碳酸氫銨溶液滴加到硫酸錳凈化液中,控制反應液的最終pH在6.5~7.0,得到MnCO3沉淀,硫酸銨,二氧化碳和水,生成的MnCO3沉淀需經充分洗滌,檢驗洗滌是否完全的方法是取最后一次洗滌液檢驗是否含有硫酸根離子設計;
(4)Ksp (MnCO3)=c(Mn2+)•c(CO32-),當Mn2+沉淀完全時,c(CO32-)=1.8×10-11/1.0×10-5=1.8×10-6 mol•L-1,若Mg2+也能形成沉淀,則要求Mg2+>2.6×10-5/1.8×10-6=14.4 mol•L-1,Mg2+的濃度0.01mol/L遠小于14.4 mol•L-1.
解答 解:濕法浸出軟錳礦(主要成分為MnO2,含少量Fe、Al、Mg等雜質元素)制備高純碳酸錳,加入濃硫酸和植物粉浸出過濾得到濾液除去雜質,加入碳酸氫銨形成沉淀通過一系列操作得到高純碳酸錳,
(1)軟錳礦的主要成分為MnO2,錳的化合價為+4價,產品中的錳為+2價,可知加入的植物粉是一種還原劑,
故答案為:作還原劑;
(2)使用碳酸錳調pH的優勢是不引入新的雜質;酸性溶液中二氧化錳氧化過氧化氫為氧氣,本身被還原為錳離子,反應的離子方程式為:MnO2+H2O2+2H+=Mn2++2H2O+O2↑,
故答案為:增加MnCO3的產量(或不引入新的雜質等);MnO2+H2O2+2H+=Mn2++2H2O+O2↑;
(3)依據碳酸氫銨受熱易分解分析,溫度控制35℃以下的原因是防止碳酸氫銨分解,在30℃~35℃下,將碳酸氫銨溶液滴加到硫酸錳凈化液中,控制反應液的最終pH在6.5~7.0,得到MnCO3沉淀,硫酸銨,二氧化碳和水,反應的化學方程式為:MnSO4+2NH4HCO3 $\frac{\underline{\;30℃-35℃\;}}{\;}$MnCO3+(NH4)2SO4+CO2↑+H2O,生成的MnCO3沉淀需經充分洗滌,檢驗洗滌是否完全的方法是取最后一次洗滌液檢驗是否含有硫酸根離子設計,取最后一次的洗滌濾液1~2 mL 于試管中,向其中滴加用鹽酸酸化的BaCl2溶液,若無白色沉淀產生,則表明已洗滌干凈.
故答案為:減少碳酸氫銨的分解,提高原料利用率;MnSO4+2NH4HCO3 $\frac{\underline{\;30℃-35℃\;}}{\;}$MnCO3+(NH4)2SO4+CO2↑+H2O;取最后一次的洗滌濾液1~2 mL 于試管中,向其中滴加用鹽酸酸化的BaCl2溶液,若無白色沉淀產生,則表明已洗滌干凈;
(4)Ksp (MnCO3)=c(Mn2+)•c(CO32-),當Mn2+沉淀完全時,c(CO32-)=$\frac{1.8×1{0}^{-11}}{1.0}$×10-5=1.8×10-6 mol•L-1,若Mg2+也能形成沉淀,則要求Mg2+>2.6×10-5/1.8×10-6=14.4 mol•L-1,Mg2+的濃度0.01mol/L遠小于14.4 mol•L-1,若凈化液中的c(Mg2+)=10-2mol/L,說明Mg2+的存在不會影響MnCO3的純度,
故答案為:Ksp (MnCO3)=c(Mn2+)•c(CO32-),當Mn2+沉淀完全時,c(CO32-)=$\frac{1.8×1{0}^{-11}}{1.0}$×10-5=1.8×10-6 mol•L-1,若Mg2+也能形成沉淀,則要求Mg2+>2.6×10-5/1.8×10-6=14.4 mol•L-1,Mg2+的濃度0.01mol/L遠小于14.4 mol•L-1,若凈化液中的c(Mg2+)=10-2mol/L,說明Mg2+的存在不會影響MnCO3的純度.
點評 本題考查了制備方案的設計,為高頻考點,題目難度中等,明確流程分析及混合物分離方法、發生的反應為解答的關鍵,試題知識點較多,充分考查了學生的分析能力及化學實驗、化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 加大清潔能源的開發利用,提高資源的利用率 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,可以實現“碳”的循環利用 | |
| C. | 加大鉛酸蓄電池、含汞鋅錳干電池的生產,滿足消費需求 | |
| D. | 對工業廢水、生活污水凈化處理,減少污染物的排放 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 25℃時,pH=13的Ba(OH)2溶液中含有的OH-數目為0.1NA | |
| B. | 1molNa與足量O2反應,生成Na2O和Na2O2的混合物,轉移2NA個電子 | |
| C. | 標準狀況下,2.24L辛烷中所含極性共價鍵的數目為1.8 NA | |
| D. | 電鍍銅時,若陰極得到電子數為2NA個,則陽極質量減少64g |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
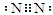 .
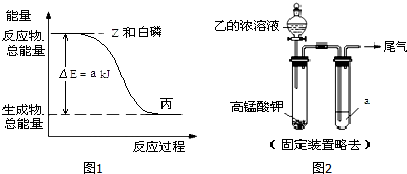
.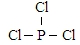 .白磷固體和 Z 氣體反應,生成 1mol 液態丙時,能量變化如圖1所示,寫出該反應的熱化學方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固體和 Z 氣體反應,生成固態丁時,放熱 bkJ,則 1mol 固態丁轉化為液態丙時的反應熱△H=(a-$\frac{b}{4}$ )kJ/mol.
.白磷固體和 Z 氣體反應,生成 1mol 液態丙時,能量變化如圖1所示,寫出該反應的熱化學方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固體和 Z 氣體反應,生成固態丁時,放熱 bkJ,則 1mol 固態丁轉化為液態丙時的反應熱△H=(a-$\frac{b}{4}$ )kJ/mol.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 固態>液態>氣態 | B. | 液態>固態>氣態 | C. | 氣態>液態>固態 | D. | 氣態>固態>液態 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
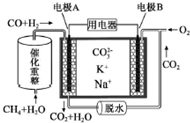
| A. | 反應CH4+H2O$\frac{\underline{\;催化劑\;}}{△}$3H2+CO,每消耗1molCH4轉移6mol 電子 | |
| B. | 電極A上CO參與的電極反應為:CO+CO32--2e-═2CO2↑ | |
| C. | 電池工作時,CO32-向電極B移動 | |
| D. | 電極B上發生的電極反應為:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com