
 .
.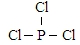 .白磷固體和 Z 氣體反應,生成 1mol 液態丙時,能量變化如圖1所示,寫出該反應的熱化學方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固體和 Z 氣體反應,生成固態丁時,放熱 bkJ,則 1mol 固態丁轉化為液態丙時的反應熱△H=(a-$\frac{b}{4}$ )kJ/mol.
.白磷固體和 Z 氣體反應,生成 1mol 液態丙時,能量變化如圖1所示,寫出該反應的熱化學方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固體和 Z 氣體反應,生成固態丁時,放熱 bkJ,則 1mol 固態丁轉化為液態丙時的反應熱△H=(a-$\frac{b}{4}$ )kJ/mol.分析 X、Y、Z為不同短周期非金屬元素的氣態單質,Y+X→甲(g),Y+Z→乙(g).甲、乙可化合生成離子化合物,則該化合物為NH4Cl,甲的相對分子質量小于乙,則甲為NH3,乙為HCl,Y為H2,X為N2,Z為Cl2.
(1)X為N2,氮原子之間有3對共用電子對;
(2)白磷(P4)在氯氣中燃燒可生成液態丙為PCl3,生成固體丁為PCl5,其中PCl3分子中各原子最外層均是8電子結構,P原子與Cl原子之間形成1對共用電子對;
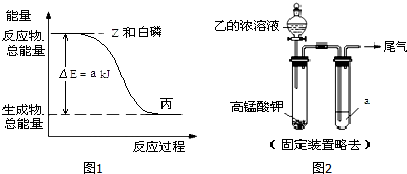
由圖可知,白磷固體和氯氣反應生成PCl3的反應為放熱反應,注明物質的聚集狀態與反應熱書寫熱化學方程式;
根據蓋斯定律計算1mol 固態丁轉化為液態丙時的反應熱;
(3)氯氣的氧化性大于碘的氧化性,將氯氣通入淀粉KI溶液中生成碘單質,溶液變藍;氯氣具有強氧化性,與過量氨氣反應生成NH4Cl和N2;
(4)若在通入SO2氣體的同時加入Cl2,發生反應為SO2+Cl2+2H2O═H2SO4+2HCl,若在通入SO2氣體的同時加入NH3,溶液中存在大量的SO3-.
解答 解:X、Y、Z為不同短周期非金屬元素的氣態單質,Y+X→甲(g),Y+Z→乙(g).甲、乙可化合生成離子化合物,則該化合物為NH4Cl,甲的相對分子質量小于乙,則甲為NH3,乙為HCl,Y為H2,X為N2,Z為Cl2.
(1)X為N2,氮原子之間有3對共用電子對,電子式為: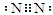 ,
,
故答案為: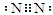 ;
;
(2)白磷(P4)在氯氣中燃燒可生成液態丙為PCl3,生成固體丁為PCl5,其中PCl3分子中各原子最外層均是8電子結構,P原子與Cl原子之間形成1對共用電子對,結構簡式為: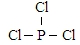 ;
;
由圖可知,白磷固體和氯氣反應生成1mol PCl3 時放出熱量為a kJ,反應熱化學方程式為:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol;
1mol 白磷固體和 氯氣 氣體反應,生成固態PCl5時放熱 bkJ,則反應熱化學方程式為:$\frac{1}{4}$P4(s)+$\frac{5}{2}$Cl2(g)=PCl5(s)△H=-$\frac{b}{4}$ kJ/mol,
根據蓋斯定律,可得:PCl5(s)=(g)=PCl3(l)+Cl2(g)△H=(a-$\frac{b}{4}$ )kJ/mol,
故答案為: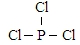 ;$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol;(a-$\frac{b}{4}$ )kJ/mol;
;$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol;(a-$\frac{b}{4}$ )kJ/mol;
(3)氯氣的氧化性大于碘的氧化性,將氯氣通入淀粉KI溶液中生成碘單質,溶液變藍,即a溶液為淀粉KI溶液,
氯氣具有強氧化性,與過量氨氣反應生成NH4Cl和N2,反應的方程式為8NH3+3Cl2=6NH4Cl+N2,
故答案為:淀粉KI;8NH3+3Cl2=6NH4Cl+N2;
(4)若在通入SO2氣體的同時加入Cl2,發生反應為SO2+Cl2+2H2O═H2SO4+2HCl,在BaCl2溶液中生成BaSO4沉淀,若在通入SO2氣體的同時加入NH3,溶液中存在大量的SO3-,可生成沉淀BaSO3,
故答案為:Cl2、NH3.
點評 本題考查較為綜合,涉及無機物的推斷、電子式、熱化學方程式、氧化性的比較等問題,側重考查學生對知識的遷移運用能力的考查,需要學生具備扎實的基礎.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1mol•L-1 | B. | 2mol•L-1 | C. | 3mol•L-1 | D. | 4mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
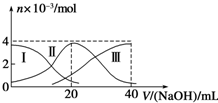
| A. | 等濃度的NaOH溶液與H2A溶液按2:1混合后,其溶液中水的電離程度比純水大 | |
| B. | 當V(NaOH)=20 mL時,溶液中離子濃度大小關系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| C. | NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) | |
| D. | 向上述加入20mLNaOH溶液后所得溶液中再加入水的過程中,pH可能減少 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .該陽離子中存在的化學鍵有共價鍵.
.該陽離子中存在的化學鍵有共價鍵. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題


 ,在一定條件下Y與BrCl(一氯化溴,與鹵素單質性質相似)按物質的量1:1發生加成反應,生成的產物可能有6種.
,在一定條件下Y與BrCl(一氯化溴,與鹵素單質性質相似)按物質的量1:1發生加成反應,生成的產物可能有6種. .
.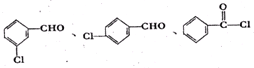 (不考慮立體異構).
(不考慮立體異構).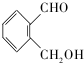 為有機原料制備化合物
為有機原料制備化合物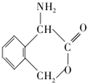 的合成路線流程圖(無機試劑任選).
的合成路線流程圖(無機試劑任選). )
)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
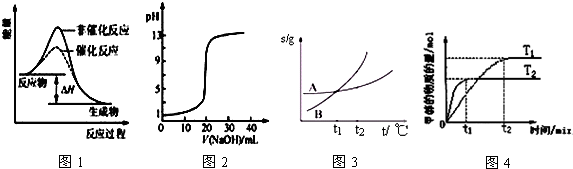
| A. | 圖1表示某吸熱反應分別在有、無催化劑的情況下反應過程中的能量變化 | |
| B. | 圖2表示0.1000 mol•L-1NaOH溶液滴定20.00mL0.1000 mol•L-1CH3COOH溶液所得到的滴定曲線 | |
| C. | 圖3表示A、B兩物質的溶解度隨溫度變化情況,將tl℃時A、B的飽和溶液分別升溫至t2℃時,溶質的質量分數B=A | |
| D. | 圖4表示在其他條件相同時,分別在T1、T2溫度下由CO2和H2合成甲醇的物質的量隨時間變化情況,則CO2和H2合成甲醇是吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
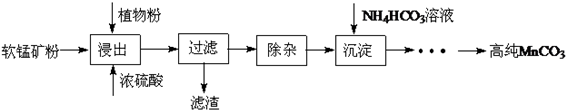
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分別用H2O2、KMnO4分解制O2,當制得等質量O2時,轉移電子數之比為1:2 | |
| B. | 等質量的O2與O3中,氧原子的個數比為3:2 | |
| C. | CaCl2及CaO2固體中陰、陽離子數之比均為2:1 | |
| D. | 10mL 0.3mol/LNaCl與30mL0.1mol/LAlCl3溶液中Cl-物質的量濃度比為1:3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com