
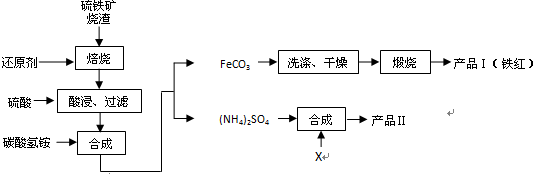
分析 Fe2O3、Fe3O4、FeO與還原劑反應生成鐵,鐵和稀硫酸反應生成硫酸亞鐵和氫氣,過濾時用到的儀器有鐵架臺、漏斗、燒杯、玻璃棒等,所以濾液中的主要溶質是硫酸亞鐵;硫酸亞鐵與碳酸氫銨反應得到碳酸亞鐵和硫酸銨,實驗室進行煅燒操作所需儀器有酒精燈、泥三角、三腳架、玻璃棒、坩堝、坩堝鉗;碳酸亞鐵與氧氣反應生成了氧化鐵和二氧化碳;硫酸銨與氯化鉀反應生成硫酸鉀和氯化銨,根據硫酸鉀的溶解度隨溫度變化不大,可用蒸發結晶、趁熱過濾、洗滌、干燥得到硫酸鉀,檢驗產品II中是否含有氯化物雜質需先除去SO4,再檢驗Cl-,以此解答該題,
(1)若焙燒時還原劑碳燃燒產生的氣體為CO,與氧化鐵反應生成鐵和二氧化碳氣體;
(2)溶液中Fe2+具有還原性,可被空氣中氧氣氧化含量將下降;
(3)碳酸氫銨不穩定,加熱易分解;
(4)流程圖可以看出酸浸、過濾后濾液中的溶質主要是硫酸亞鐵,硫酸亞鐵和碳酸氫銨反應生成碳酸亞鐵和硫酸銨,過濾后反應Ⅱ中硫酸銨與X反應生成硫酸鉀和氯化銨,因此加入的X應為氯化鉀,過濾得到硫酸鉀,說明硫酸鉀溶解度小;
(5)碳酸亞鐵與氧氣反應生成了氧化鐵和二氧化碳;
(6)因檢驗產品II中是否含有氯化物雜質需先除去SO4,再檢驗Cl-.
解答 解:(1)若焙燒時還原劑碳燃燒產生的氣體為CO,與氧化鐵反應生成鐵和二氧化碳氣體,方程式為Fe2O3+3CO$\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO2,
故答案為:Fe2O3+3CO$\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO2;
(2)具有還原性,可被空氣中氧氣氧化,方程式為4Fe2++O2+4H+=4Fe3++2H2O,
故答案為:4Fe2++O2+4H+=4Fe3++2H2O;
(3)碳酸氫銨不穩定,加熱易分解,應在溫度較低的情況下加熱,
故答案為:防止碳酸氫銨分解;
(4)由流程圖可以看出酸浸、過濾后濾液中的溶質主要是硫酸亞鐵,硫酸亞鐵和碳酸氫銨反應生成碳酸亞鐵和硫酸銨,過濾后反應Ⅱ中硫酸銨與X反應生成硫酸鉀和氯化銨,因此加入的X應為氯化鉀,要過濾得到硫酸鉀,說明在此條件下硫酸鉀的溶解度小于氯化銨的溶解度,反應的離子方程式為:2K++SO42-=K2SO4↓,
故答案為:KCl;2K++SO42-=K2SO4↓;
(5)碳酸亞鐵與氧氣反應生成了氧化鐵和二氧化碳,4FeCO3+O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+4CO2,
故答案為:4FeCO3+O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+4CO2;
(6)因檢驗產品II中是否含有氯化物雜質需先除去SO4,再檢驗Cl-,所以滴加過量Ba(NO3)2溶液,過濾后向濾液滴加AgNO3溶液,
故答案為:滴加過量Ba(NO3)2溶液,過濾后向濾液滴加AgNO3溶液.
點評 本題綜合考查物質的分離、提純以及制備,為高考常見題型,側重于學生的分析能力和實驗能力的考查,注意把握實驗的目的和原理,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 甲、乙中都是鋁過量 | B. | 甲中鋁過量,乙中堿過量 | ||
| C. | 甲中酸過量,乙中鋁過量 | D. | 甲、乙中都是鋁不足 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

 .
.  ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 l,2二溴乙烷可作汽油抗爆劑的添加劑,常溫下它是無色液體,密度2.189cm-3,沸點131.4℃,熔點9.79℃,不溶于水,易溶于醇、醚、丙酮等有機溶劑.在實驗室中可用下列反應制備1,2二溴乙烷.
l,2二溴乙烷可作汽油抗爆劑的添加劑,常溫下它是無色液體,密度2.189cm-3,沸點131.4℃,熔點9.79℃,不溶于水,易溶于醇、醚、丙酮等有機溶劑.在實驗室中可用下列反應制備1,2二溴乙烷.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某研究性學習小組為合成1-丁醇,查閱資料得知一條合成路線:
某研究性學習小組為合成1-丁醇,查閱資料得知一條合成路線:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 不變 D.溶液中
不變 D.溶液中 減小
減小| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 離子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com