
| 1000ρw |
| M |
| n |
| V |
| 1000ρw |
| M |
| 1000×1.16×36.5% |
| 36.5 |
| 0.25L×1mol/L |
| 11.6mol/L |
| n |
| V |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
| A、在一定溫度壓強下,14 gN2所含的體積可能為11.2 L |
| B、標準狀況下,足量NaOH溶液與2.24 LCl2反應,轉移電子數目為0.1NA |
| C、標準狀況下,11.2 LH2O中含有的電子數為5NA |
| D、加熱條件下,足量Cl2與1 molFe粉充分反應,轉移的電子數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
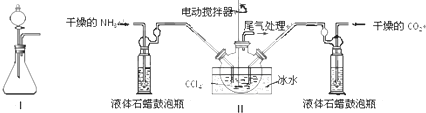
| 實驗步驟 | 預期現象和結論 |
| 步驟1:取少量固體樣品于試管中,加入蒸餾水至固體溶解. | 得到無色溶液 |
| 步驟2:向試管中加入過量的BaCl2溶液,靜置 | 若溶液不變渾濁,證明固體中不含碳酸銨. |
| 步驟3:向試管中繼續加入 |
查看答案和解析>>
科目:高中化學 來源: 題型:
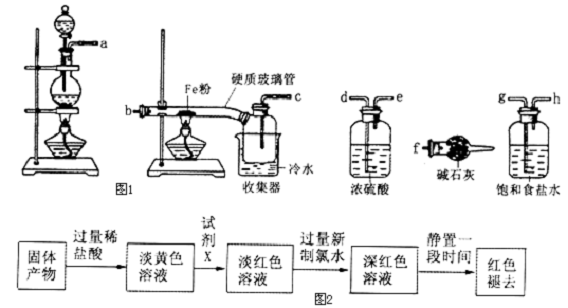
查看答案和解析>>
科目:高中化學 來源: 題型:
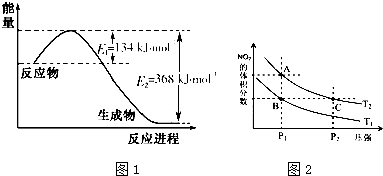 氮是地球上含量豐富的一種元素,氮及其化合物在生產、生活中有著重要作用.
氮是地球上含量豐富的一種元素,氮及其化合物在生產、生活中有著重要作用.| T/K | 298 | 398 | 498 |
| 平衡常數K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 甲 | 乙 | 丙 | |
| 合金質量/mg | 510 | 765 | 918 |
| 氣體體積/mL | 560 | 672 | 672 |
查看答案和解析>>
科目:高中化學 來源: 題型:
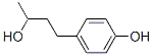 最近我國質檢總局通報,日本佳麗寶公司生產的化妝品使用后皮膚會出現白斑,其中的有害成分為杜鵑醇(結構如圖),有關杜鵑醇的說法不正確的是( )
最近我國質檢總局通報,日本佳麗寶公司生產的化妝品使用后皮膚會出現白斑,其中的有害成分為杜鵑醇(結構如圖),有關杜鵑醇的說法不正確的是( )| A、分子式為:C10H14O2 |
| B、水溶液酸性一定比碳酸強 |
| C、能與FeCl3溶液發生顯色反應 |
| D、最多可與含3molBr2的溴水反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com