
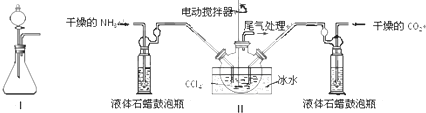
| 實驗步驟 | 預期現象和結論 |
| 步驟1:取少量固體樣品于試管中,加入蒸餾水至固體溶解. | 得到無色溶液 |
| 步驟2:向試管中加入過量的BaCl2溶液,靜置 | 若溶液不變渾濁,證明固體中不含碳酸銨. |
| 步驟3:向試管中繼續(xù)加入 |
| 實驗步驟 | 預期現象和結論 |
| 步驟3:少量澄清石灰水 | 溶液變渾濁 |
| 1.97 |
| 197 |
| 3.95-0.01×79 |
| 78 |
| 0.04 |
| 0.04+0.01 |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
| A、二氧化硫 | B、二氧化碳 |
| C、二氧化氮 | D、可吸入顆粒物 |
查看答案和解析>>
科目:高中化學 來源: 題型:
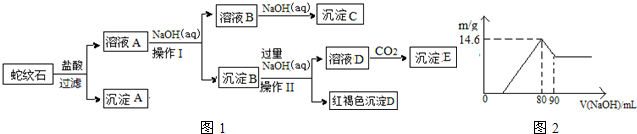
| 氫氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 開始沉淀pH | 1.9 | 3.3 | 9.4 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 實驗編號 | T/K | 大理石規(guī)格 | HNO3濃度/mol?L-1 | 實驗目的 |
| ① | 298 | 粗顆粒 | 2.00 | (Ⅰ)實驗①和②探究HNO3濃度對該反應速率的影響; (Ⅱ)實驗①和 (Ⅲ)實驗①和 |
| ② | ||||
| ③ | ||||
| ④ |

查看答案和解析>>
科目:高中化學 來源: 題型:
 某興趣小組設計研究銅和稀硝酸反應速率[v (NO)]的實驗.試回答下列問題:
某興趣小組設計研究銅和稀硝酸反應速率[v (NO)]的實驗.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
| 180-200℃ |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com