
| A. | 室溫下,氨水與氯化銨的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | 向NaHCO3溶液中加入少量NaOH固體,可抑制HCO3-的水解,使c(HCO3-)增大 | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 常溫下,等體積pH=a的醋酸與pH=b的NaOH溶液恰好中和時,a+b=14 |
分析 A.常溫下pH=7的溶液中c(H+)=c(OH-),根據電荷守恒可知c(Cl-)=c(NH4+);
B.氫氧化鈉與碳酸氫根離子反應生成碳酸根離子和水,導致碳酸氫根離子濃度減小;
C.銨根離子部分水解,溶液顯示酸性,則c(H+)>c(OH-),由于水解程度較小,則c(NH4+)>c(SO42-);
D.常溫下,等體積pH=a的醋酸與pH=b的NaOH溶液恰好中和時,則酸和堿的物質的量濃度相等.
解答 解:A.室溫下,氨水與氯化銨的pH=7的混合溶液中一定滿足:c(H+)=c(OH-),根據電荷守恒可得:c(Cl-)=c(NH4+),故A正確;
B.向NaHCO3溶液中加入少量NaOH固體,氫氧根離子與碳酸氫根離子反應,使c(HCO3-)減小,故B錯誤;
C.0.1 mol•L-1的(NH4)2SO4溶液中,由于銨根離子部分水解,溶液顯示酸性,則c(H+)>c(OH-),由于水解程度較小,則c(NH4+)>c(SO42-),溶液中離子濃度大小為:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故C正確;
D.常溫下,等體積pH=a的醋酸與pH=b的NaOH溶液恰好中和時,則酸和堿的物質的量濃度相等,即c(CH3COOH)=$\frac{c({H}^{+})}{α}$=$\frac{1{0}^{-a}}{α}$mol/L=10 b-14mol/L(0<α<1),
所以α=1014-a-b(0<α<1),整理可得:a+b>14,故D錯誤;
故選AC.
點評 本題考查了離子濃度大小比較,題目難度中等,明確鹽的水解原理、電荷守恒、物料守恒的應用方法為解答關鍵,注意掌握判斷離子濃度大小常用方法,試題培養了學生的靈活應用能力.


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:選擇題
| A. | 硫酸鈉溶液和醋酸鉛溶液均能使蛋白質變性 | |
| B. | 油脂是高級脂肪酸的甘油酯,均不能發生氫化反應 | |
| C. | H2N-CH2-COOH既能與鹽酸反應、又能與氫氧化鈉溶液反應 | |
| D. | 合成橡膠 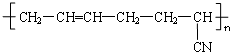 的單體之一是CH3-C≡C-CH3 的單體之一是CH3-C≡C-CH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ | |
| B. | 加入KSCN顯紅色的溶液:K+、NH4+、Cl-、CO32- | |
| C. | 無色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| D. | 含有大量NaClO的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 硫化鈉是一種重要的化工原料.工業上用硫酸鈉與碳反應得到硫化鈉.反應方程式如下:
硫化鈉是一種重要的化工原料.工業上用硫酸鈉與碳反應得到硫化鈉.反應方程式如下:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚氯乙烯塑料制品可用于食品包裝 | |
| B. | H7N9型禽流感病毒在高溫條件下被殺死的過程是蛋白質變性 | |
| C. | 高純度的硅單質用于制作光導纖維,光導纖維有導電性 | |
| D. | 研發使用高效催化劑,可提高反應中原料的轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 綠色植物進行光合作用時,將太陽能轉化為化學能“儲存”起來 | |
| B. | 物質發生化學反應過程中一定伴隨著能量變化 | |
| C. | 可將反應“NaOH+HCl═NaCl+H2O”的化學能通過原電池轉化為電能 | |
| D. | 化學反應使放熱還是吸熱,取決于生成物具有的總能量和反應物具有的總能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
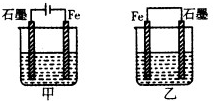 如圖所示裝置,均盛有等體積等濃度的稀硫酸,工作一段時間后當甲乙裝置中通過電子的物質的量相同時,下列說法正確的是( )
如圖所示裝置,均盛有等體積等濃度的稀硫酸,工作一段時間后當甲乙裝置中通過電子的物質的量相同時,下列說法正確的是( )| A. | A、甲乙兩裝置中的石墨電極分別是陰極、負極 | |
| B. | 鐵棒的腐蝕程度:甲>乙 | |
| C. | 石墨電極上發生反應的電極反應式相同 | |
| D. | 溶液的pH:甲減小,乙增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
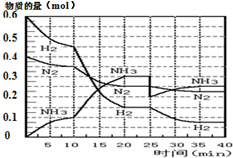 氨的合成原理為:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.現在500℃、20MPa時,將N2、H2置于一個容積為2L的密閉容器中發生反應,反應過程中各物質的物質的量變化如圖.
氨的合成原理為:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.現在500℃、20MPa時,將N2、H2置于一個容積為2L的密閉容器中發生反應,反應過程中各物質的物質的量變化如圖.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com