
 硫化鈉是一種重要的化工原料.工業上用硫酸鈉與碳反應得到硫化鈉.反應方程式如下:
硫化鈉是一種重要的化工原料.工業上用硫酸鈉與碳反應得到硫化鈉.反應方程式如下:分析 (1)幾種元素中原子半徑最大的是Na,根據鈉原子的電子排布分析;
(2)a. 非極性分子在微波爐中加熱時溫度不變;
b.極性分子也能溶于水;
c.非極性分子在電場中通過時不偏向;
d.極性分子常溫常壓下也可能為氣態;
(3)S元素化合價由-$\frac{2}{x}$升高為+6,而NaBrO3被還原為NaBr,Br元素化合價由+5價降低為-1價,反應中Na2Sx與NaBrO3的物質的量之比為3:10,根據氧化還原反應中轉移電子相等進行解答;
(4)硫氫化鈉與少量硫酸銅溶液反應生成硫化銅沉淀和硫化氫;硫化鈉與硫酸銅生成沉淀,硫氫化鈉與硫酸銅生成沉淀和氣體;
(5)根據酸性強的酸能制備酸性弱的酸的原理分析,硫化氫具有強還原性能被亞硫酸和硝酸氧化.
解答 解:(1)幾種元素中原子半徑最大的是Na,鈉原子的電子排布式為1s22s22p63s1,則Na原子有4種能級不同的電子;
故答案為:4;
(2)a. 非極性分子在微波爐中加熱時溫度不變,已知微波爐中加熱少量干冰數分鐘,干冰溫度不變,說明二氧化碳是非極性分子,故a正確;
b.極性分子也能溶于水,如HCl屬于極性分子,易溶于水,故b錯誤;
c.非極性分子的正負電荷中心重疊,不顯電性,在電場中通過時不偏向,二氧化碳在電場中通過不偏向,則二氧化碳屬于非極性分子,故c正確;
d.極性分子常溫常壓下也可能為氣態,如氨氣、HCl等極性分子在常溫下也是氣體,故d錯誤;
故答案為:ac;
(3)Na2Sx在堿性溶液中可被NaBrO3氧化為Na2SO4,S元素化合價由-$\frac{2}{x}$升高為+6,而NaBrO3被還原為NaBr,Br元素化合價由+5價降低為-1價,反應中Na2Sx與NaBrO3的物質的量之比為3:10,則:x×[6-(-$\frac{2}{x}$)]×3=10×[5-(-1)],解得x=3,
故答案為:3;
(4)硫氫化鈉與少量硫酸銅溶液反應生成硫化銅沉淀和硫化氫,其反應的離子方程式為:2HS-+Cu2+=CuS↓+H2S↑;硫化鈉與硫酸銅生成沉淀,硫氫化鈉與硫酸銅生成沉淀和氣體,所以能用硫酸銅溶液來鑒別硫化鈉溶液和硫氫化鈉溶液;
故答案為:2HS-+Cu2+=CuS↓+H2S↑;可以,分別向兩種溶液中緩緩加入少量的硫酸銅溶液,若產生氣泡的是硫氫化鈉,不產生的是硫化鈉;
(5)電離常數越大,酸性越強,硫化氫具有強還原性能被亞硫酸和硝酸氧化,所以不能用硝酸和亞硫酸來制備氫硫酸,HF不能盛放在玻璃容器中,所以不能選用HF,則可以用醋酸制備氫硫酸;
故答案為:b.
點評 本題考查了硫元素及其化合物的性質,題目涉及的知識點較多,側重于考查學生對基礎知識的綜合應用能力,注意把握電子排布規律、非極性分子、氧化還原反應原理的應用物質的檢驗鑒別等,題目難度中等.


 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:解答題
 甲醇燃料電池(DNFC)被認為是21世紀電動汽車最佳候選動力源.
甲醇燃料電池(DNFC)被認為是21世紀電動汽車最佳候選動力源.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
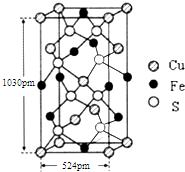 黃血鹽(亞鐵氰化鉀,K4[Fe(CN)6])易溶于水,廣泛用作食鹽添加劑(抗結劑),食鹽中黃血鹽的最大使用量為10mg•kg-1.黃血鹽經長時間火炒,超過400℃時會分解生成劇毒的氰化鉀.回答下列問題:
黃血鹽(亞鐵氰化鉀,K4[Fe(CN)6])易溶于水,廣泛用作食鹽添加劑(抗結劑),食鹽中黃血鹽的最大使用量為10mg•kg-1.黃血鹽經長時間火炒,超過400℃時會分解生成劇毒的氰化鉀.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
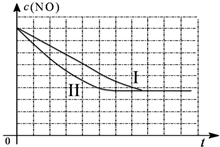
| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 實驗 編號 | T(℃) | NO初始濃度 (mol/L) | CO初始濃度 (mol/L) | 催化劑的比表面積 (m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑥ | B. | ④⑥ | C. | ②③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
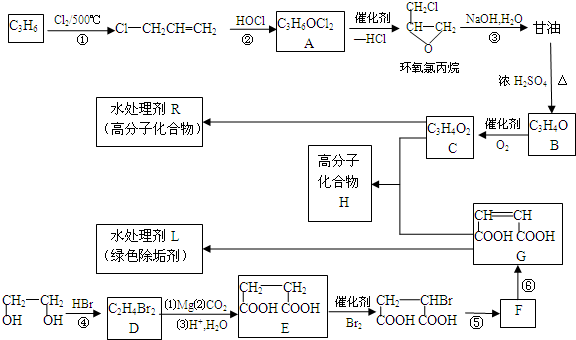
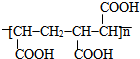 .
.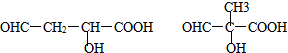
 的合成路線(無機原料任選).
的合成路線(無機原料任選).查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 室溫下,氨水與氯化銨的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | 向NaHCO3溶液中加入少量NaOH固體,可抑制HCO3-的水解,使c(HCO3-)增大 | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 常溫下,等體積pH=a的醋酸與pH=b的NaOH溶液恰好中和時,a+b=14 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4+、OH-、H3O+ | B. | Na+、Mg2+、S2- | C. | F-、NH2-、Cl- | D. | Li+、Na+、K+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電池放電過程中,正極電極反應式為:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 充電過程中陰極的電極反應式:H2O+M+e-═MH+OH-,H2O中的H被M還原 | |
| C. | 充電過程中OH-離子從陽極向陰極遷移 | |
| D. | NiMH電池中可以用KOH溶液、氨水等作為電解質溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com