
 甲醇燃料電池(DNFC)被認為是21世紀電動汽車最佳候選動力源.
甲醇燃料電池(DNFC)被認為是21世紀電動汽車最佳候選動力源.分析 (1)1molCH3OH完全燃燒生成穩定的氧化物為氣態二氧化碳和液態水,放出熱量726.51kJ/mol,以此書寫熱化學方程式;
(2)由蓋斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1、③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,①+③得到反應②;
(3)甲醇燃料電池中,甲醇為負極,電解質為酸,甲醇失去電子生成二氧化碳;
(4)反應熱=反應物的總鍵能-生成物的總鍵能,以此解答.
解答 解:(1)1molCH3OH完全燃燒生成穩定的氧化物為氣態二氧化碳和液態水,放出熱量726.51kJ/mol,則燃燒的熱化學方程式為CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol,
故答案為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.51kJ/mol;
(2)由蓋斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol-1、③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,①+③得到反應②,則△H2=+49.0kJ•mol-1+(-241.8kJ•mol-1)=-192.8kJ•mol-1,故答案為:-192.8kJ•mol-1;
(3)甲醇燃料電池中,甲醇中C元素的化合價升高,則甲醇為負極,電解質為酸,甲醇失去電子生成二氧化碳,正極電極反應為O2+4H++4e-=2H2O,
故答案為:負;O2+4H++4e-=2H2O.
(4)已知:H-H鍵能為436kJ/mol,H-N鍵能為391kJ/mol,令N≡N的鍵能為x,
對于反應N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
反應熱=反應物的總鍵能-生成物的總鍵能,故x+3×436kJ/mol-2×3×391kJ/mol=-92kJ/mol,
解得:x=945.6 kJ/mol,故答案為:945.6 kJ/mol.
點評 本題為綜合題,涉及反應熱的計算、熱化學反應方程式的書寫、燃料電池等知識點,注重高考常考考點的考查,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2發生還原反應 | B. | H2是還原劑 | C. | Cl2被氧化 | D. | Cl2發生氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
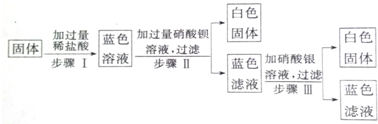
 在如圖所示的物質轉化關系中,A是一種活潑金屬,B是常見的無色液體,在常溫下C、E都是氣體.請回答下列問題:
在如圖所示的物質轉化關系中,A是一種活潑金屬,B是常見的無色液體,在常溫下C、E都是氣體.請回答下列問題: .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
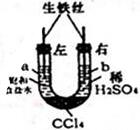 利用如圖裝置進行實驗,開始時,a、b兩處液面相平,密封好,放置一段時間.下列說法不正確的是( )
利用如圖裝置進行實驗,開始時,a、b兩處液面相平,密封好,放置一段時間.下列說法不正確的是( )| A. | a管發生吸氧腐蝕,b管發生析氫腐蝕 | |
| B. | 一段時間后,a管液面高于b管液面 | |
| C. | a處、b處溶液的pH都增大 | |
| D. | a、b兩處具有相同的電極反應式:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸鈉溶液和醋酸鉛溶液均能使蛋白質變性 | |
| B. | 油脂是高級脂肪酸的甘油酯,均不能發生氫化反應 | |
| C. | H2N-CH2-COOH既能與鹽酸反應、又能與氫氧化鈉溶液反應 | |
| D. | 合成橡膠 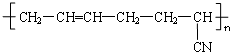 的單體之一是CH3-C≡C-CH3 的單體之一是CH3-C≡C-CH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 步驟 | 操 作 | 現 象 |
| ① | 用pH試紙檢驗 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振蕩,靜置 | CCl4層呈橙色 |
| ③ | 向②所得溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀產生 |
| ④ | 將③過濾,向濾液中加入AgNO3溶液和稀HNO3 | 有白色沉淀產生 |
| A. | 可能含有的離子是①③⑥ | B. | 肯定沒有的離子只有② | ||
| C. | 不能確定的離子只有⑤ | D. | 肯定含有的離子是①③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 硫化鈉是一種重要的化工原料.工業上用硫酸鈉與碳反應得到硫化鈉.反應方程式如下:
硫化鈉是一種重要的化工原料.工業上用硫酸鈉與碳反應得到硫化鈉.反應方程式如下:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com