
 硫代硫酸鈉(Na2S2O3)可由亞硫酸鈉和硫粉通過化合反應制得.已知:Na2S2O3在酸性溶液中不能穩定存在.
硫代硫酸鈉(Na2S2O3)可由亞硫酸鈉和硫粉通過化合反應制得.已知:Na2S2O3在酸性溶液中不能穩定存在.| 編號 | 1 | 2 | 3 | 4 |
| 溶液的體積/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2標準溶液的體積/mL | 19.99 | 19.98 | 17.13 | 20.03 |
分析 在加熱條件下,銅和濃硫酸發生氧化還原反應生成二氧化硫,所以A中發生的反應為Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;打開K1,關閉K2,在C中Na2CO3和S、SO2反應生成Na2S2O3,Na2S2O3溶液具有弱堿性和較強的還原性,所以酸性條件下不能存在,二氧化硫不能完全反應且二氧化硫有毒,會污染空氣,所以用NaOH吸收未反應的SO2;C中溶液的pH接近7時即停止C中的反應,打開K2,關閉K1,二氧化硫有毒,應該用B中溶液吸收二氧化硫,二氧化硫屬于酸性氧化物,且有還原性,所以可以堿性物質或氧化性物質吸收二氧化硫,
(1)①A裝置制備二氧化硫,Cu與濃硫酸在加熱條件下反應生成硫酸銅、二氧化硫與水;
②不足通入二氧化硫,可以停止C中反應,用B裝置吸收A中多余的二氧化硫;
③Na2S2O3•5H2O的溶解度隨溫度升高顯著增大,產品通過重結晶方法提純;
④吸收A中產生的多余SO2防止空氣污染;
(2)①Na2S2O3反應完畢,再加入碘的標準溶液,碘與淀粉變藍色;
②第3次實驗消耗標準液的體積與其它3次相差比較大,應舍棄,1、2、4次實驗的標準液平均值為消耗標準液體積,由方程式可知n(Na2S2O3•5H2O)=n(S2O32-)=2n(I2),進而計算Na2S2O3•5H2O在產品中的質量分數.
解答 解:(1)①A裝置制備二氧化硫,Cu與濃硫酸在加熱條件下反應生成硫酸銅、二氧化硫與水,反應方程式為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②不足通入二氧化硫,可以停止C中反應,用B裝置吸收A中多余的二氧化硫,Ⅱ中“停止C中的反應”的操作是:打開K2,關閉K1,
故答案為:打開K2,關閉K1;
③Na2S2O3•5H2O的溶解度隨溫度升高顯著增大,產品通過重結晶方法提純,
故答案為:重結晶;
④二氧化硫會污染空氣,裝置B的作用是:在C中的反應停止后吸收A中產生的多余SO2防止空氣污染,
故答案為:在C中的反應停止后吸收A中產生的多余SO2防止空氣污染;
(2)①加入最后一滴I2標準溶液后,溶液變藍,且半分鐘內顏色不改變,說明Na2S2O3反應完畢,滴定到達終點,
故答案為:加入最后一滴I2標準溶液后,溶液變藍,且半分鐘內顏色不改變;
②第3次實驗消耗標準液的體積與其它3次相差比較大,應舍棄,1、2、4次實驗的標準液平均值為消耗標準液體積,即消耗標準液體積為$\frac{(19.99+19.98+20.03)mL}{3}$=20mL,由2S2O32-+I2═S4O62-+2I-,可知5.5g樣品中n(Na2S2O3•5H2O)=n(S2O32-)=2n(I2)=2×0.02L×0.05mol/L×$\frac{100mL}{10mL}$=0.02mol,則m(Na2S2O3•5H2O)=0.02mol×248g/mol=4.96g,則Na2S2O3•5H2O在產品中的質量分數為$\frac{4.96g}{5.5g}$×100%=90.2%,
故答案為:90.2%.
點評 本題考查制備實驗方案設計,為高頻考點,側重考查學生的分析、實驗和計算能力,涉及物質制備、物質的量的計算、離子方程式書寫、基本操作等知識點,明確實驗原理及物質性質是解本題關鍵,難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯和甲烷都能發生加成反應 | |
| B. | 煤焦油、石油、花生油都屬于烴 | |
| C. | 甲烷、乙烯、苯都可通過石油分餾得到 | |
| D. |  + +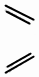 $\stackrel{△}{→}$ $\stackrel{△}{→}$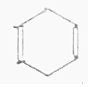 反應屬于加成反應 反應屬于加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
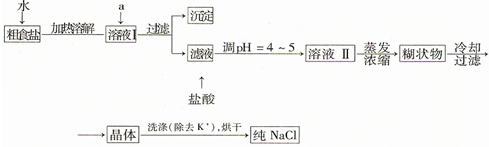
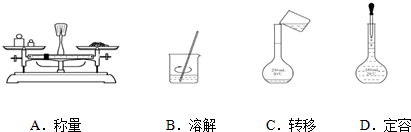
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
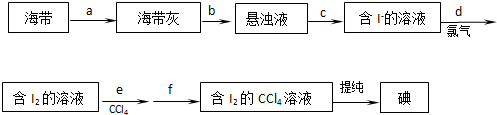
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
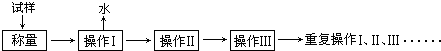
 電子天平 b.
電子天平 b. 坩堝 c.
坩堝 c. 干燥器 d.
干燥器 d. 酒精噴燈
酒精噴燈| 加熱前質量 | 加熱后質量 | |
| m1(容器) | m2(容器+晶體) | m3(容器+無水硫酸銅) |
| 5.200g | 7.900g | 6.900g |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
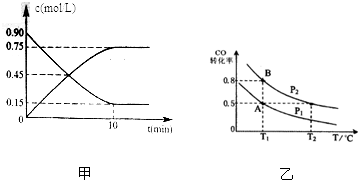
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com