
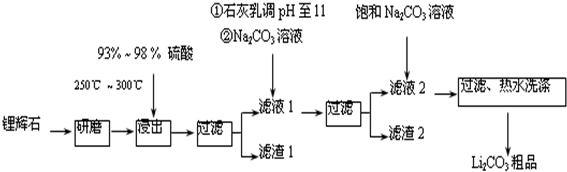
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
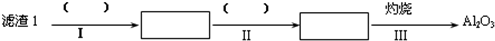
分析 根據Li2O•Al2O3•4SiO2+H2SO4(濃)$\frac{\underline{\;250℃-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓可知鋰輝石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)經過研磨、加熱、濃硫酸酸化得到可溶性的硫酸鋰、少量硫酸鈣、少量硫酸鎂和不溶的Al2O3•4SiO2•H2O,經過過濾,得到濾渣1:Al2O3•4SiO2•H2O,向濾液1中加入石灰乳、碳酸鈉,使Mg(OH)2、CaCO3更利于析出,以便形成濾渣2,過濾得到濾液2為硫酸鋰溶液,向濾液2中加入飽合碳酸鈉溶液,得到碳酸鋰,熱水洗滌Li2CO3,其溶解度隨溫度升高而減小,可減少Li2CO3的損失,得到最終產物碳酸鋰,
(1)步驟Ⅱ中鋁離子與氨水反應生成氫氧化鋁沉淀;
(2)石灰乳是氫氧化鈣,提供氫氧根離子和鈣離子,更完全的沉淀鎂離子和碳酸根離子;
(3)依據圖表分析可知碳酸鋰溶解度隨溫度升高減小;
(4)①Li2CO3溶于鹽酸作電解槽的陽極液,陽極液中離子失電子,發生氧化反應,所以陽極反應為2C1--2e-=Cl2↑,陰極反應為2H++2e-=H2↑,離子選擇透過膜只允許陽離子通過,電解過程中,Li+向陰極移動,而陰極電解后富余大量的OH-,陽極的Li+通過離子選擇透過膜到陰極,這樣陰極就得到比較純凈的LiOH;
②電解后向LiOH溶液中加入過量NH4HCO3溶液,氫氧化鋰與碳酸氫銨反應生成碳酸鋰.
解答 解:根據Li2O•Al2O3•4SiO2+H2SO4(濃)$\frac{\underline{\;250℃-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓可知鋰輝石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)經過研磨、加熱、濃硫酸酸化得到可溶性的硫酸鋰、少量硫酸鈣、少量硫酸鎂和不溶的Al2O3•4SiO2•H2O,經過過濾,得到濾渣1:Al2O3•4SiO2•H2O,向濾液1中加入石灰乳、碳酸鈉,使Mg(OH)2、CaCO3更利于析出,以便形成濾渣2,過濾得到濾液2為硫酸鋰溶液,向濾液2中加入飽合碳酸鈉溶液,得到碳酸鋰,熱水洗滌Li2CO3,其溶解度隨溫度升高而減小,可減少Li2CO3的損失,得到最終產物碳酸鋰,
(1)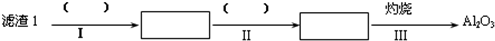 ,濾渣1是Al2O3•4SiO2•H2O,先加酸溶解,然后過濾出不溶物二氧化硅,步驟Ⅱ中在鋁離子的酸溶液中滴入氨水,生成氫氧化鋁沉淀,所以步驟Ⅱ反應是鋁離子生成氫氧化鋁的反應,反應離子方程式為:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
,濾渣1是Al2O3•4SiO2•H2O,先加酸溶解,然后過濾出不溶物二氧化硅,步驟Ⅱ中在鋁離子的酸溶液中滴入氨水,生成氫氧化鋁沉淀,所以步驟Ⅱ反應是鋁離子生成氫氧化鋁的反應,反應離子方程式為:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案為:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(2)石灰乳是氫氧化鈣,提供氫氧根離子和鈣離子,更完全的沉淀鎂離子和碳酸根離子,
故答案為:增加Ca2+、OH-的濃度,有利于Mg(OH)2、CaCO3的析出;
(3)向濾液2中加入飽和Na2CO3溶液,過濾后,用“熱水洗滌”,圖表中碳酸鋰溶解度隨溫度升高減小,減少沉淀的損失,
故答案為:Li2CO3的溶解度隨溫度升高而減小,熱水洗滌可減少Li2CO3的損失;
(4)①Li2CO3溶于鹽酸作電解槽的陽極液,陽極液中氯離子失電子,發生氧化反應,所以陽極反應為2C1--2e-=Cl2↑,
故答案為:2C1--2e-=Cl2↑;
②電解后向LiOH溶液中加入過量NH4HCO3溶液,氫氧化鋰與碳酸氫銨反應生成碳酸鋰的方程式為:2LiOH+NH4HCO3=Li2CO3+NH3+2H2O,
故答案為:2LiOH+NH4HCO3=Li2CO3+NH3+2H2O.
點評 本題考查了物質生產流程的分析判斷,流程分析,物質性質的應用是解題關鍵,主要是鋁及其化合物性質的應用,氧化鋁的提取方法,題目難度中等.


科目:高中化學 來源:2016-2017學年山東省高二上10月月考化學卷(解析版) 題型:選擇題
下列關于反應熱的說法正確的是
A.已知C(石墨,s)=C(金剛石,s) △H>0,說明金剛石比石墨穩定
B.已知H+(aq)+OH-(aq)=H2O(l) △H=-57.4kJ/mol,則含20.0gNaOH的稀溶液與稀醋酸完全中和,放出熱量小于28.7kJ
C.已知甲烷的燃燒熱為890.3kJ/mol,則表示甲烷燃燒熱的熱化學方程式可表示為:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol
D.將0.5molN2和1.5molH2置于密閉容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g)  2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省高一上10月月考化學卷(解析版) 題型:填空題
(1)與16gO2所含原子總數相同的NH3標準狀況下體積是 L;
(2)已知2LAl2(SO4)3溶液中c(Al3+)=3mol/L,則c(SO42-)= ,與3L mol/LNa2SO4中SO42-的物質的量濃度相等。
(3)同溫同壓下,同體積的NH3和H2S氣體的質量比為 ;同質量的NH3和H2S氣體的體積比為 ,其中含有的氫的原子個數比為 ;若二者氫原子數相等,它們的體積比為 。
(4)在標準狀況下,8.96L的CH4和CO的混合氣體,二者對氫氣相對密度是9.5,混合氣體平均摩爾質量為 ,混合氣體中CH4的體積為 ,一氧化碳的質量分數為 ,二者原子個數比為 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省高一上10月月考化學卷(解析版) 題型:選擇題
在標準狀況下①6.72LCH4 ②3.01×1023個HCl分子 ③13.6gH2S ④0.2molNH3,下列對這四種氣體的關系從大到小表達正確的是
a.體積②>③>①>④ b.密度②>④>③>①
c.質量②>③>①>④ d.氫原子個數①>③>④>②
A.abc B.bcd C.abcd D.acd
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
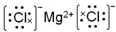 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃硝酸或氫氟酸存放在配有磨口塞的棕色玻璃瓶中 | |
| B. | 汽油或煤油存放在帶橡皮塞的棕色玻璃瓶中 | |
| C. | 用堿式滴定管準確量取25.00mL的KMnO4溶液 | |
| D. | 新制氯水或硝酸銀溶液存放在配有磨口塞的棕色玻璃瓶中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4分子的比例模型: | B. | NH3的電子式: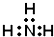 | ||
| C. | Ca2+的結構示意圖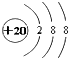 | D. | 次氯酸的結構式:H-Cl-O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com