
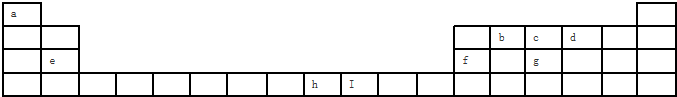
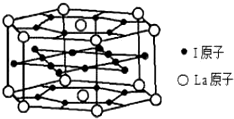
| 1 |
| 2 |
| 1 |
| 6 |
| 1 |
| 2 |
| 1 |
| 2 |


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
| A、鋁是地殼里含量最多的金屬元素 |
| B、在常溫下,鋁不能與氧氣反應 |
| C、鋁是一種比較活潑的金屬 |
| D、Al箔在空氣中受熱可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 |
查看答案和解析>>
科目:高中化學 來源: 題型:
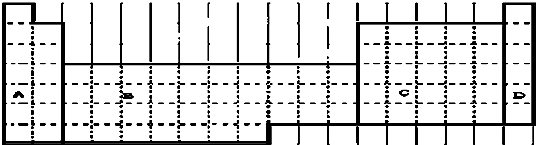
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
| 濃度/mol?L-1 時間/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
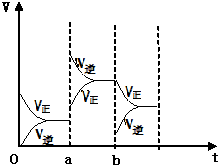 (1)有甲、乙兩容器,甲的容積固定,乙的容積可變.在一定溫度下,向甲中通入3molN2和4molH2,反應達到平衡時,生成NH3物質的量為amol.
(1)有甲、乙兩容器,甲的容積固定,乙的容積可變.在一定溫度下,向甲中通入3molN2和4molH2,反應達到平衡時,生成NH3物質的量為amol.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com