
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
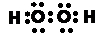 ,故答案為:
,故答案為: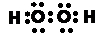 ;
;

科目:高中化學 來源: 題型:
| A、配平后的化學方程式為Fe3O4+10HNO3(稀)═3Fe(NO3)3+NO↑+5H2O |
| B、反應中每還原0.4 mol氧化劑,就有1.2 mol電子轉移 |
| C、稀HNO3在反應中只表現氧化性 |
| D、磁性氧化鐵中的所有鐵元素全部被氧化 |
查看答案和解析>>
科目:高中化學 來源: 題型:
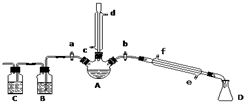 某興趣小組在實驗室用加熱乙醇、濃H2SO4、溴化鈉和少量水的混合物來制備溴乙烷,并檢驗反應的部分副產物.設計了如圖裝置,其中夾持儀器、加熱儀器及冷卻水管沒有畫出.請根據實驗步驟回答:
某興趣小組在實驗室用加熱乙醇、濃H2SO4、溴化鈉和少量水的混合物來制備溴乙烷,并檢驗反應的部分副產物.設計了如圖裝置,其中夾持儀器、加熱儀器及冷卻水管沒有畫出.請根據實驗步驟回答:查看答案和解析>>
科目:高中化學 來源: 題型:
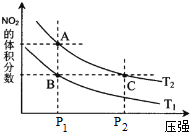
| c(H2)c(CO) |
| c(H2O) |
| 溫度/°C | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:
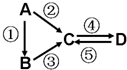 A、B、C、D均為中學化學常見的純凈物,A是單質.它們之間有如下的反應關系:
A、B、C、D均為中學化學常見的純凈物,A是單質.它們之間有如下的反應關系:查看答案和解析>>
科目:高中化學 來源: 題型:
| Nutrition Facts 營養成分 500mL含量 | |
| 熱量 710kJ | 碳水化合物 42g |
| 蛋白質 0g | 脂肪酸 0g |
| 維生素C 100mg | |
| 中國居民膳食營養素日推薦攝入量(RNI): 維生素C 100mg | |
查看答案和解析>>
科目:高中化學 來源: 題型:
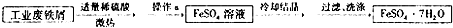
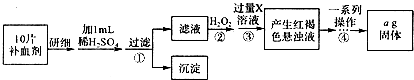
查看答案和解析>>
科目:高中化學 來源: 題型:
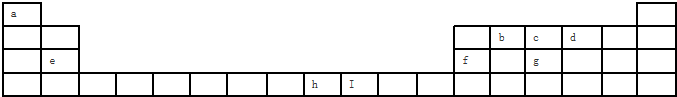
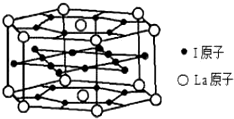
查看答案和解析>>
科目:高中化學 來源: 題型:
| 電離能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
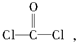 每個COCl2分子內含有
每個COCl2分子內含有查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com