
 鐵是日常生活中用途最廣、用量最大的金屬材料.
鐵是日常生活中用途最廣、用量最大的金屬材料.分析 (1)根據鐵和濃硫酸鈍化的原理解答;
(2)①濕棉花含有水蒸氣,對反應來說提供了水,鐵在高溫下與水反應生成四氧化三鐵和氫氣,據此分析解答即可;
②產物四氧化三鐵中有+2價的鐵和+3價的鐵,還有可能有過量的鐵;
(3)①鐵是金屬具有還原性,濃硫酸具有氧化性,鐵被氧化成+3價鐵,濃硫酸被還原成+4價的硫;
②生成的SO2具有還原性,通入足量溴水中,發生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,結合關系式:SO2→BaSO4求出SO2的體積分數.
解答 解:(1)常溫下,鐵在濃硫酸中發生鈍化現象使鐵表面形成一層致密穩定的氧化膜,故鐵制品容器可以盛放濃硫酸,
故答案為:濃硫酸使鐵表面形成一層致密穩定的氧化膜;
(2)①因為是鐵和水蒸氣的反應,試管內有鐵粉,所以濕棉花主要是提供水蒸氣;鐵在高溫下與水反應生成四氧化三鐵和氫氣,反應方程式為:3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2,
故答案為:提供水蒸氣;3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2;
②鐵和水蒸氣反應,產物為四氧化三鐵和氫氣,加入過量鹽酸,固體完全溶解,必發生反應:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,所以所得溶液中存在的陽離子是一定有Fe2+、H+,四氧化三鐵黑色固體中可能含有過量的鐵,可能將三價鐵離子全部轉化成二價鐵離子,Fe+2Fe3+═3Fe2+,所以所得溶液中存在的陽離子是一定有Fe2+、H+,可能有Fe3+,
故答案為:b;
(3)①鐵和濃硫酸反應鐵被氧化成+3價鐵,濃硫酸被還原成+4價的硫,生成硫酸鐵和二氧化硫和水,反應方程式為:2Fe+6H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O;
故答案為:2Fe+6H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O;
②SO2具有還原性,通入足量溴水中,發生SO2+Br2+2H2O=2HBr+H2SO4,離子方程式的書寫,將產物中的氫溴酸和硫酸拆成離子,所以離子方程式為SO2+Br2+2H2O═2Br-+SO42-+4H+,生成的硫酸遇到氯化鋇會產生白色沉淀,可以先洗滌然后再過濾來獲得純凈的硫酸鋇沉淀,則n(混合氣體)=$\frac{0.672L}{22.4L/mol}$=0.03mol,
SO2 ~BaSO4
1mol 233g
n 4.66g
n=0.02mol,
則 SO2的體積分數:$\frac{0.02}{0.03}$×100%=66.7%,
故答案為:66.7%.
點評 本題考查鐵及其化合物的性質實驗,結合相關的化學反應原理是解答的關鍵,本題難度中等.


 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案科目:高中化學 來源: 題型:選擇題
| A. | Cl2和SO2 | B. | CO2和NH3 | C. | NO 和CO2 | D. | NO2和SO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
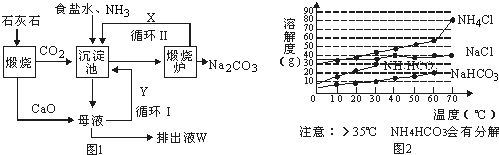
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
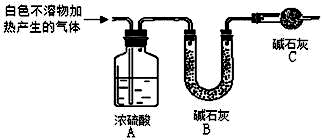
| 實驗序號 | 實驗 | 實驗現象 | 結論 |
| 實驗Ⅰ | 取一小段鎂條,用砂紙擦去表面氧化膜,將其放入足量的滴有酚酞的飽和NaHCO3溶液中,充分反應后過濾 | 產生較多氣泡和白色不溶物,溶液有淺紅色變成紅色 | |
| 實驗Ⅱ | 將實驗Ⅰ中收集到的氣體點燃 | 能安靜燃燒,火焰呈淡藍色 | 氣體成分為 ①氫氣 |
| 實驗Ⅲ | 取實驗Ⅰ中白色不溶物濾出、洗滌,取少量加入足量稀鹽酸 | ②產生氣泡沉淀全部溶解 | 白色不溶物中含有 MgCO3 |
| 實驗Ⅳ | ③CaCl2或BaCl2 | 產生白色沉淀,溶液紅色變淺 | 溶液中存在CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molFe溶于過量硝酸,電子轉移數為2NA | |
| B. | 1molN2與4molH2反應生成的NH3分子數為2NA | |
| C. | 標準狀況下,2.24LCCl4含有的共價鍵數為0.4NA | |
| D. | 14g乙烯和丙烯混合氣體中的氫原子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
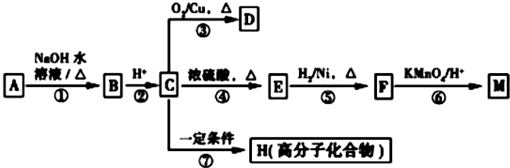
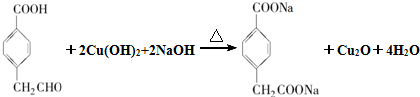
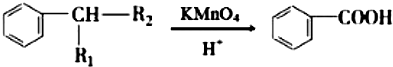 (R1、R2表示烴基或氫原子)
(R1、R2表示烴基或氫原子)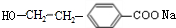 .
.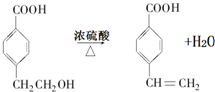 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
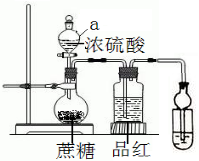 在燒瓶放20克蔗糖,依次加入少量水、20mL濃硫酸,蔗糖逐漸變黑,體積膨脹,形成疏松多孔的黑面包,燒瓶發燙,品紅溶液顏色變淡.請回答:
在燒瓶放20克蔗糖,依次加入少量水、20mL濃硫酸,蔗糖逐漸變黑,體積膨脹,形成疏松多孔的黑面包,燒瓶發燙,品紅溶液顏色變淡.請回答:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com