

分析 (1)還原Fe2O3的實驗中,發現生成的黑色粉末各組分均能被磁鐵吸引,往黑色粉末中滴加鹽酸,觀察到有氣泡產生,證明含有金屬鐵;
(2)①裝置A是啟普發生器的原理應用,關閉止水夾,依據氣體壓強的關系,從長頸漏斗加入水至一定高度,看水面是否變化分析是否漏水;
②氣體進入C裝置前需要除去水蒸氣,否則以炸裂玻璃管;
③D中白色粉末硫酸銅變藍色證明反應有水生成,黑色固體中含有Fe3O4 被氫氣還原生成水,判斷可以含有;
(3)黑色粉末加入足量鹽酸溶解后,滴入KSCN溶液,不變血紅色可能有兩種情況,一種是五鐵離子存在,一種是有鐵離子存在,和過量的鐵反應生成亞鐵離子;
(4)Ⅲ流程是黑色粉末加入過量鹽酸溶解后,加入足量氨水沉淀離子,加入足量氫氧化鈉保證堿性環境下離子全部沉淀,操作Ⅱ是過濾、洗滌得到沉淀,放在坩堝內灼燒制恒重得到紅褐色固體為氧化鐵;
(5)依據反應的化學方程式計算判斷.
解答 解:(1)還原Fe2O3的實驗中,發現生成的黑色粉末各組分均能被磁鐵吸引,應為鐵或四氧化三鐵,換貨二者混合物,往黑色粉末中滴加鹽酸,觀察到有氣泡產生,證明含有金屬鐵,故答案為:Fe;
(2)①裝置A是啟普發生器的原理應用,關閉止水夾,依據氣體壓強的關系,從長頸漏斗加入水至一定高度,看水面是否變化分析是否漏水;
故答案為:關閉止水夾K,往長頸漏斗加水至漏斗內的液面高于導氣管,靜置一段時間后液面差保持不變,說明裝置A的氣密性良好;
②氣體進入C裝置前需要除去水蒸氣,否則以炸裂玻璃管;吸收氫氣中的水蒸氣用濃硫酸溶液,故答案為:濃硫酸;
③D中白色粉末硫酸銅變藍色證明反應有水生成,黑色固體中含有Fe3O4 被氫氣還原生成水,發生反應4H2+Fe3O4=3Fe+4H2O,判斷可以含有;依據和酸反應生成氫氣和驗證生成水判斷黑色固體為鐵和四氧化三鐵,
故答案為:黑色固體含有Fe和Fe3O4;
(3)黑色粉末加入足量鹽酸溶解后,滴入KSCN溶液,不變血紅色可能有兩種情況,一種是五鐵離子存在,一種是有鐵離子存在,和過量的鐵反應生成亞鐵離子,所以方案不正確,
故答案為:不可行,因Fe3O4溶于鹽酸生成Fe3+與Fe反應生成Fe2+,溶液不變色;
(4)Ⅲ流程是黑色粉末加入過量鹽酸溶解后,加入足量氨水沉淀離子,加入足量氫氧化鈉保證堿性環境下離子全部沉淀,操作Ⅱ是過濾、洗滌得到沉淀,放在坩堝內灼燒制恒重得到紅褐色固體為氧化鐵,
故答案為:過濾;洗滌;
(5)依據反應的化學方程式,結合鐵元素守恒計算判斷;
Fe+Fe3O4$\stackrel{足量稀鹽酸}{→}$FeCl2 FeCl3$\stackrel{足量氨水,足量氫氧化鈉}{→}$Fe(OH)2 Fe(OH)3$\stackrel{灼燒至恒重}{→}$Fe2O3;
依據反應過程中鐵元素守恒,3.2gFe2O3物質的量=$\frac{3.2g}{160g/mol}$=0.02mol;
設鐵物質的量為X,四氧化三鐵物質的量為Y,得到:56X+232Y=2.88 X+3Y=0.02×2
解方程得到X=0.01mol;Y=0.01mol;鐵的質量為5.6g;四氧化三鐵的質量為2.32g,
故答案為:Fe:0.56g,Fe3O4:2.32g.
點評 本題考查了探究物質組成,測定物質含量的定量實驗操作和實驗設計,主要考查鐵及其化合物的性質應用,實驗基本操作的分析判斷,實驗現象的推斷和應用,元素守恒的計算應用,綜合性較強,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 若混合氣體的密度不再改變時,該反應不一定達到平衡狀態 | |
| B. | 2min后,加壓會使正反應速率增大,逆反應速率減小,平衡正向移動 | |
| C. | 反應過程中A和B的轉化率之比為3:1 | |
| D. | 該條件下此反應的化學平衡常數的數值約為0.91 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
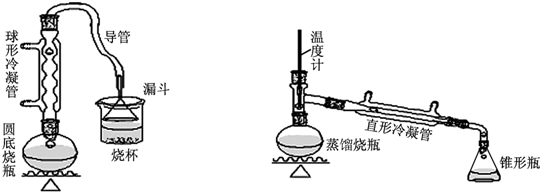
| 物質 | 熔點/℃ | 沸點/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鐵是日常生活中用途最廣、用量最大的金屬材料.
鐵是日常生活中用途最廣、用量最大的金屬材料.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無水CuSO4 | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 組成物質分別是 | |||||
| 質 量 為(g) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com