
碳、硫的含量影響鋼鐵性能,碳、硫含量的一種測定方法是將鋼樣中碳、硫轉化為氣體,再進行測定。
(1)在高溫下將x克鋼樣中碳、硫轉化為CO2、SO2(氣體a)。
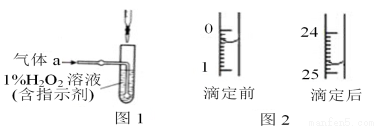
(2)將氣體a通入測硫裝置中(如圖1),采用滴定法測定硫的含量。
①H2O2氧化SO2的化學方程式:___________ ______。
②將①的吸收液稀釋至250mL,取1/10該溶液進行滴定,用酸式滴定管取液時趕走氣泡的操作是_ 。
③用c mol/L 標準 NaOH 溶液滴定取出的溶液,則選擇的指示劑為_________,直至加入最后一滴NaOH溶液時,溶液顏色_________,即可停止滴定。
④某次滴定前后,NaOH 溶液的液面如圖2,其體積讀數為________________________。若滴定3次,消耗NaOH溶液體積的平均值為z mL,則該鋼樣中硫的質量分數為______________________(用 x、c、z表示)。
⑤下列操作會造成測定結果偏高的是__________。
a.水洗后未用標準液潤洗堿式滴定管 b.加入1 mL酸堿指示劑
c.滴定終點時,尖嘴出現氣泡 d.滴定終點俯視滴定管的刻度
將氣體 a 通入測碳裝置中(如圖),采用重量法測定碳的含量。

⑥為準確測定CO2,需除去SO2的干擾,除去SO2的裝置是_______(填序號)。
⑦計算鋼樣中碳的質量分數,應測量的數據是__________。去掉裝置E,測得碳的質量分數 (填 “偏小”、“無影響”或“偏大”)
⑧上述操作中,測定CO2前先除去SO2,但測定SO2前卻沒除CO2,是否合理?若不合理,說明如何改正;若合理,說明理由_____________________。
科目:高中化學 來源:2016-2017學年天津市高一上期末化學卷(解析版) 題型:計算題
硫酸是極其重要的化工原料,在工業、農業、醫藥、軍事等領域應用廣泛。工業上通常用接觸法制硫酸,主要原料是硫鐵礦和空氣。接觸法制硫酸的生產過程大致可 分為三個階段:二氧化硫的制取和凈化;二氧化硫轉化為三氧化硫;三氧化硫的吸收和硫酸的生成。為了防止環境污染并對尾氣進行綜合利用,硫酸廠常用氨水吸收尾氣的 SO2、SO3 等氣體,再向吸收液中加入濃硫酸,以制取高濃度的 SO2 及(NH4)2SO4和NH4HSO4固體。為了測定測定上述(NH4)2SO4和NH4HSO4固體混合物的組成,現稱取該樣品四份,分別 加入相同濃度的 NaOH 溶液 50.00 mL,加熱至 120℃左右,使氨氣全部逸出[(NH4)2SO4和NH4HSO4的分解溫度均高于 200℃],測得有關實驗數據如下(標準狀況):
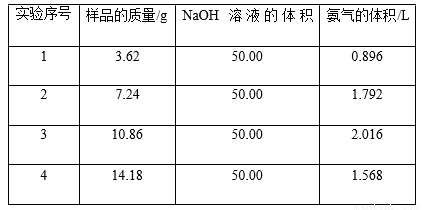
(1)由 1 組數據直接推測:1.81 g 樣品進行同樣實驗時,生成氨氣的體積(標準狀況)為 L。
(2)試計算該混合物中(NH4)2SO4和NH4HSO4的物質的量之比為 。
(3)求所用 NaOH 溶液的物質的量濃度 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省等名校高二上期末化學卷(解析版) 題型:選擇題
常溫下,pH均為9的NaOH和CH3COONa兩種溶液中,設由水電離產生的OH-濃度為Amol?L-1和Bmol?L-1,則A與B的關系是( )
A.A=10-4B B.A>B C.B=10-4A D.A=B
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省樂山市高二上學期期末化學試卷(解析版) 題型:選擇題
設NA為阿伏加德羅常數的值,下列敘述錯誤的是
A.1.8g18O2分子與1.8g18O3分子中含有的中子數不同
B.7.8gNa2S和7.8g Na2O2中含有的陰離子數目均為0.1NA
C.23.4 g NaCl晶體中含有0.1NA個如圖所示的結構單元
D.含16 g氧原子的二氧化硅晶體中含有的δ鍵數目為2NA
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省樂山市高二上學期期末化學試卷(解析版) 題型:選擇題
某原子的一種激發態為1s22s12p1,則該元素在周期表中的位置為
A. 第二周期ⅡA族 B. 第二周期ⅢA族
C. 第二周期ⅠA族 D. 第二周期ⅣA族
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省簡陽市高二上學期期末化學試卷(解析版) 題型:選擇題
下面提到的問題中,與鹽的水解有關的是 ( )
①明礬和FeCl3可作凈水劑
②為保存FeCl3溶液,要在溶液中加少量鹽酸
③用NaHCO3與Al2(SO4)3兩種溶液可作泡沫滅火劑
④在NH4Cl溶液中加入金屬鎂會產生氫氣
A.①③④ B.②③ C.全部 D.①②④
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省簡陽市高二上學期期末化學試卷(解析版) 題型:選擇題
下列各離子組在指定的溶液中一定能大量共存的是 ( )
①常溫在C(H+)/C(OH-)= 10-10溶液中:K+、Na+、CH3COO-、SO42﹣
②常溫pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③水電離出的H+濃度c(H+)=10﹣12mol•L?1的溶液中:Cl﹣、NO3﹣、Na+、S2O32﹣
④使甲基橙變紅色的溶液中:Fe3+、NO3﹣、Na+、SO42﹣
A.①②③ B.①②④ C.②③④ D.①③④
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省廣安市高一上學期期末化學試卷(解析版) 題型:推斷題
已知A為淡黃色固體,R是地殼中含量最多的金屬元素的單質,T為生活中使用最廣泛的金屬單質,D是具有磁性的黑色晶體,C、F是無色無味的氣體,H是白色沉淀,W溶液中滴加KSCN溶液出現紅色。

(1)物質D的化學式為___________,E化學式為___________;
(2)點燃氣體F前必須先_________________________;
(3)H在潮濕空氣中變成M的實驗現象是_______________,化學方程式為_______________,其反應類型是 反應(填基本反應類型)。
(4)B和R在溶液中反應生成F的離子方 程式為____________________,該反應屬 反應 (填基本反應類型)。
程式為____________________,該反應屬 反應 (填基本反應類型)。
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長沙市高三模擬一化學試卷(解析版) 題型:填空題
[化學——選修3:物質結構與性質]磷存在于人體所有細胞中,是維持骨骼和牙齒的必要物質,幾乎參與所有生理上的化學反應。回答下列問題:
(1)基態P原子的核外電子排布式為 ________,有________個未成對電子。
(2)磷的一種同素異形體——白磷(P4)的立體構型為________,其鍵角為__________,推測其在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度。
(3)兩種三角錐形氣態氫化物膦(PH3)和氨(NH3)的鍵角分別為93.6º和107º,試分析PH3的鍵角小于NH3的原因 ______________________________。
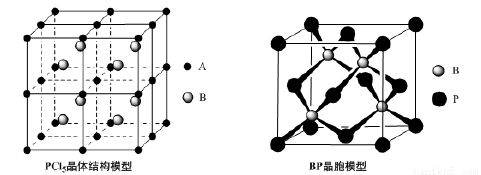
(4)常溫下PCl5是一種白色晶體,其立方晶系晶體結構模型如上左圖所示,由A、B兩種微粒構成。將其加熱至148℃熔化,形成一種能導電的熔體。已知A、B兩種微粒分別與CCl4、SF6互為等電子體,則A為______,其中心原子雜化軌道類型為__________,B為________。
(5)磷化硼(BP)是一種超硬耐磨涂層材料,上右圖為其立方晶胞,其中的每個原子均滿足8電子穩定結構,試判斷其熔點 __________(填“高于”或“低于”)金剛石熔點。
已知其B—P鍵長均為x cm,則其密度為 ________g﹒cm—3(列出計算式即可)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com