
下列各離子組在指定的溶液中一定能大量共存的是 ( )
①常溫在C(H+)/C(OH-)= 10-10溶液中:K+、Na+、CH3COO-、SO42﹣
②常溫pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③水電離出的H+濃度c(H+)=10﹣12mol•L?1的溶液中:Cl﹣、NO3﹣、Na+、S2O32﹣
④使甲基橙變紅色的溶液中:Fe3+、NO3﹣、Na+、SO42﹣
A.①②③ B.①②④ C.②③④ D.①③④
 智趣寒假作業云南科技出版社系列答案
智趣寒假作業云南科技出版社系列答案科目:高中化學 來源:2016-2017學年天津市高一上期末化學卷(解析版) 題型:選擇題
下列離子方程式書寫正確的是
A.少量的鈉投入 Ca( HCO 3 ) 2 溶液中:2Na+2Ca2++2HCO3-=2Na++2CaCO3↓+H2↑
B.硫酸與氫氧化鋇溶液反應:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.大理石與醋酸溶液反應:CaCO3+2H+=Ca2++H2O+CO2↑
D.向 Ba(OH ) 2 溶液中逐滴加入 NH4HSO4 溶液直至過量:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3↑+2H2O
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省樂山市高二上學期期末化學試卷(解析版) 題型:選擇題
在某溫度下,某一密閉容器中,M、N、R三種氣體濃度的變化如圖a所示,若其它條件不變,當溫度分別為T1和T2時,N的體積分數與時間關系如圖b所示.則下列結論正確的是
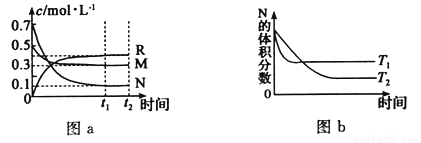
A.該反應的熱化學方程式M(g)+3N(g) 2R(g)△H>0
2R(g)△H>0
B.達到平衡后,若其他條件不變,減小容器體積,平衡向逆反應方向移動
C.達到平衡后,若其它條件不變,升高溫度,正、逆反應速度均增大,M的轉化率減小
D.達到平衡后,若其他條件不變,通入稀有氣體,平衡一定向正反應方向移動
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省簡陽市高二上學期期末化學試卷(解析版) 題型:實驗題
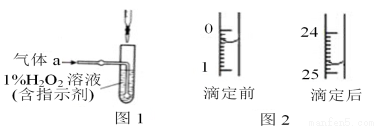
碳、硫的含量影響鋼鐵性能,碳、硫含量的一種測定方法是將鋼樣中碳、硫轉化為氣體,再進行測定。
(1)在高溫下將x克鋼樣中碳、硫轉化為CO2、SO2(氣體a)。
(2)將氣體a通入測硫裝置中(如圖1),采用滴定法測定硫的含量。
①H2O2氧化SO2的化學方程式:___________ ______。
②將①的吸收液稀釋至250mL,取1/10該溶液進行滴定,用酸式滴定管取液時趕走氣泡的操作是_ 。
③用c mol/L 標準 NaOH 溶液滴定取出的溶液,則選擇的指示劑為_________,直至加入最后一滴NaOH溶液時,溶液顏色_________,即可停止滴定。
④某次滴定前后,NaOH 溶液的液面如圖2,其體積讀數為________________________。若滴定3次,消耗NaOH溶液體積的平均值為z mL,則該鋼樣中硫的質量分數為______________________(用 x、c、z表示)。
⑤下列操作會造成測定結果偏高的是__________。
a.水洗后未用標準液潤洗堿式滴定管 b.加入1 mL酸堿指示劑
c.滴定終點時,尖嘴出現氣泡 d.滴定終點俯視滴定管的刻度
將氣體 a 通入測碳裝置中(如圖),采用重量法測定碳的含量。

⑥為準確測定CO2,需除去SO2的干擾,除去SO2的裝置是_______(填序號)。
⑦計算鋼樣中碳的質量分數,應測量的數據是__________。去掉裝置E,測得碳的質量分數 (填 “偏小”、“無影響”或“偏大”)
⑧上述操作中,測定CO2前先除去SO2,但測定SO2前卻沒除CO2,是否合理?若不合理,說明如何改正;若合理,說明理由_____________________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省簡陽市高二上學期期末化學試卷(解析版) 題型:選擇題
下列有關方程式書寫正確的是( )
A.醋酸溶液與氫氧化鈉溶液反應的離子方程式為H++OH-=H2O
B.H2S在水溶液中的電離:H2S+H2O H3O++ HS-
H3O++ HS-
C.甲烷的燃燒熱為890.3 kJ·mol-1,則甲烷燃燒的熱化學方程式可表示為:
CH4 (g)+2O2 (g) == CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D.雙氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+H+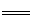 I2+ 2H2O
I2+ 2H2O
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省簡陽市高二上學期期末化學試卷(解析版) 題型:選擇題
可逆反應∶2NO2 2NO+O2在固定體積密閉容器中反應,達到平衡狀態的標志是( )
2NO+O2在固定體積密閉容器中反應,達到平衡狀態的標志是( )
①單位時間內生成n molO2的同時生成2n molNO2
②單位時間內生成n molO2 的同時,生成2n mol NO
③用NO2、NO、O2 的物質的量濃度變化表示的反應速率的比為2 : 2 : 1的狀態
④混合氣體的顏色不再改變的狀態
⑤混合氣體的密度不再改變的狀態
⑥混合氣體的平均相對分子質量不再改變的狀態
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省簡陽市高二上學期期末化學試卷(解析版) 題型:選擇題
用VSEPR模型預測下列分子或離子的立體結構,其中正確的是
A.CH4與CH2Cl2均為正四面體 B.BeCl2與SO2為直線形
C.BF3與PCl3為三角錐形 D.NO3—與CO 為平面三角形
為平面三角形
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省廣安市高一上學期期末化學試卷(解析版) 題型:選擇題
在邏輯上概念之間存在如圖所示關系。對下列概念之間關系的說法正確的是

A.純凈物與混合物屬于包含關系
B.化合物與氧化物屬于交叉關系
C.單質與化合物屬于并列關系
D.氧化反應與化合反應屬于并列關系
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省衡陽市高三上質檢二化學卷(解析版) 題型:實驗題
某化學興趣小組在實臉室模擬侯德榜制堿法制備純堿。主要步驟如下:
第一步:配制飽和NaCl溶液,倒入燒杯中加熱;
第一步:控制溫度在30-35 ℃。邊攪拌邊分批加入研細的NH4HCO3固體,加料完畢后,繼續保溫30分鐘;
第三步:靜置、過濾得NaHCO3晶體.用少量蒸餾水洗滌除去雜質,然后抽干;
第四步:將第二步所得固體轉入蒸發皿中,灼燒2小時,制得純堿固體,
已知:溫度高于35℃時,NH4HCO3會分解。有關鹽的溶解度(g/100g水)如下表:
鹽 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —— | —— | —— | —— |
NaHC | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | —— |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
回答下列問題:
(1)反應溫度控制在30-35℃范圍內,應采取的加熱方法為 ,反應溫度不能高于35℃的理由是 .
(2)第三步靜置后析出NaHCO3晶體的原因是 ;用蒸餾水洗滌NaHCO3晶體的目的是除去雜質粒子 (用離子符號表示)。
(3)若向過濾所得母液中加入 (填寫試劑名稱),并作進一步處理,使NaCl溶液循環使用,同時可回收NH4Cl。
(4)純堿產品不純,含有NaHCO3、NaCl等雜質。測定純堿中NaHCO3含量的方法是:準確稱取純堿樣品Wg,放入錐形瓶中加蒸餾水溶解,加l-2滴酚酞指示劑,用物質的量濃度為cmol/L的鹽酸滴定至溶液由紅色到無色(指示CO32-+H+=HCO3-反應的終點), 所用鹽酸體積為V1mL,再加1-2滴甲基橙指示劑,繼續用鹽酸滴定至溶液由黃變橙,所用鹽酸總體積為V2m L。
L。
① 實驗室配制一定體積cmol/L鹽酸需用 的儀器除了容量瓶、燒杯、量筒外還需 ;在容量瓶的使用方法中,下列操作正確的是 (填寫標號)
的儀器除了容量瓶、燒杯、量筒外還需 ;在容量瓶的使用方法中,下列操作正確的是 (填寫標號)
a.使用容量瓶前檢驗它是否漏水
b.容量瓶用蒸餾水洗凈后,再用待配溶液潤洗
c.配制溶液時,如果試樣是固體,把稱好的試樣用紙條小心倒入容量瓶中.然后加蒸餾水定容
d.用容量瓶把溶液配制完成以后.直接貼上標簽,放置備用
e.定容后蓋好瓶塞,用食指頂住瓶塞,用另一只手指托住瓶底,把容量瓶倒轉和搖動幾次
② 寫出純堿樣品中NaHCO3質量分數的計算式:NaHCO3 (%)= 。
(%)= 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com