
| A. | 實驗中,乙烯的用量不會影響該反應的反應焓變△H | |
| B. | 0.5 mol H2O(l) 完全反應放出的熱量為22.9 kJ | |
| C. | 1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和 | |
| D. | 1 mol C2H4(g)和1 mol H2O (g)中化學鍵的總鍵能大于1 mol C2H5OH(g)中化學鍵的總鍵能 |
分析 A.焓變與物質的用量無關;
B.反應中物質的量與熱量成正比,則0.5 mol H2O(g) 完全反應放出的熱量為22.9 kJ;
C.該反應為放熱反應,反應物的總能量高;
D.焓變等于反應物中鍵能之和減去生成物中鍵能之和.
解答 解:A.焓變與物質的用量無關,則實驗中,乙烯的用量不會影響該反應的反應焓變△H,故A正確;
B.反應中物質的量與熱量成正比,則0.5 mol H2O(g) 完全反應放出的熱量為22.9 kJ,則0.5 mol H2O(l) 完全反應放出的熱量小于22.9 kJ,故B錯誤;
C.該反應為放熱反應,反應物的總能量高,則1 mol C2H5OH(g)具有的能量小于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和,故C錯誤;
D.焓變等于反應物中鍵能之和減去生成物中鍵能之和,該反應為放熱反應,則1 mol C2H4(g)和1 mol H2O (g)中化學鍵的總鍵能小于1 mol C2H5OH(g)中化學鍵的總鍵能,故D錯誤;
故選A.
點評 本題考查反應熱與焓變,為高頻考點,把握反應中能量變化、焓變與物質能量及鍵能的關系為解答的關鍵,側重分析與應用能力的考查,注意焓變的計算方法,題目難度不大.


科目:高中化學 來源: 題型:實驗題
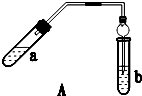 實驗室制乙酸乙酯得主要裝置如圖A所示,主要步驟①在a試管中按2:3:2的體積比配制濃硫酸、乙醇、乙酸的混合物;②按A圖連接裝置,使產生的蒸氣經導管通到b試管所盛的飽和碳酸鈉溶液(加入幾滴酚酞試液)中;③小火加熱a試管中的混合液;④等b試管中收集到約2mL產物時停止加熱.撤下b試管并用力振蕩,然后靜置待其中液體分層;⑤分離出純凈的乙酸乙酯.
實驗室制乙酸乙酯得主要裝置如圖A所示,主要步驟①在a試管中按2:3:2的體積比配制濃硫酸、乙醇、乙酸的混合物;②按A圖連接裝置,使產生的蒸氣經導管通到b試管所盛的飽和碳酸鈉溶液(加入幾滴酚酞試液)中;③小火加熱a試管中的混合液;④等b試管中收集到約2mL產物時停止加熱.撤下b試管并用力振蕩,然后靜置待其中液體分層;⑤分離出純凈的乙酸乙酯.| 實驗 編號 | 試管a中試劑 | 試管b中試劑 | 測得有機層的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1 濃硫酸 | 飽和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 1.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
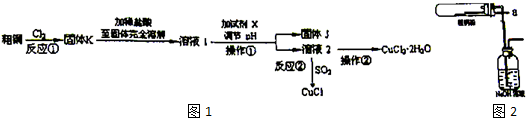
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
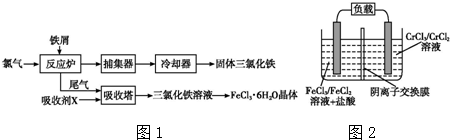
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
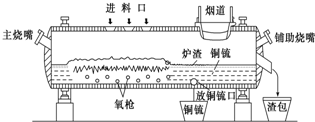
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu+2HCl═CuCl2+H2↑ | B. | Al2O3+3H2O═2Al(OH)3 | ||
| C. | Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O | D. | Ba(OH)2+SO2═BaSO4↓+H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com