
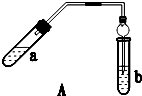
 實驗室制乙酸乙酯得主要裝置如圖A所示,主要步驟①在a試管中按2:3:2的體積比配制濃硫酸、乙醇、乙酸的混合物;②按A圖連接裝置,使產生的蒸氣經導管通到b試管所盛的飽和碳酸鈉溶液(加入幾滴酚酞試液)中;③小火加熱a試管中的混合液;④等b試管中收集到約2mL產物時停止加熱.撤下b試管并用力振蕩,然后靜置待其中液體分層;⑤分離出純凈的乙酸乙酯.
實驗室制乙酸乙酯得主要裝置如圖A所示,主要步驟①在a試管中按2:3:2的體積比配制濃硫酸、乙醇、乙酸的混合物;②按A圖連接裝置,使產生的蒸氣經導管通到b試管所盛的飽和碳酸鈉溶液(加入幾滴酚酞試液)中;③小火加熱a試管中的混合液;④等b試管中收集到約2mL產物時停止加熱.撤下b試管并用力振蕩,然后靜置待其中液體分層;⑤分離出純凈的乙酸乙酯.| 實驗 編號 | 試管a中試劑 | 試管b中試劑 | 測得有機層的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1 濃硫酸 | 飽和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 1.2 |
分析 (1)乙酸與碳酸鈉反應生成二氧化碳、乙酸鈉和水;
(2)乙酸、乙醇易溶于碳酸鈉溶液,會導致裝置內氣體減小,容易發生倒吸;乙酸乙酯與水溶液分層,分離互不相溶的液體采取分液操作;
(3)①通過對照實驗,證明H+對酯化反應具有催化作用,應保證氫離子濃度相等與物質的量相等;
②對比濃硫酸、稀硫酸生成乙酸乙酯的量的多少,說明濃硫酸濃硫酸的吸水性能夠提高乙酸乙酯產率,根據平衡移動原理分析;
③乙酸、乙醇易揮發,也可能發生其它副反應;
④乙酸乙酯在酸性、堿性條件下均可以發生水解,應選擇中性干燥劑.
解答 解:(1)乙酸與碳酸鈉反應生成二氧化碳、乙酸鈉和水,化學方程式:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑,
故答案為:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑;
(2)乙酸、乙醇易溶于碳酸鈉溶液,會導致裝置內氣體減小,容易發生倒吸,球形干燥管還可以防止倒吸;乙酸乙酯與水溶液分層,分離互不相溶的液體采取分液操作,所用儀器為分液漏斗,
故答案為:防止倒吸;分液漏斗;
(3)①通過對照實驗,證明H+對酯化反應具有催化作用,應保證氫離子濃度相等與物質的量相等,故HCl的濃度為3mol/L×2=6mol/L,鹽酸體積為6mL,
故答案為:6;6;
②催化劑為濃硫酸生成有機層厚度比3mol•L-1 H2SO4時生成有機層厚度厚,說明濃硫酸濃硫酸的吸水性能夠提高乙酸乙酯產率,原因是:濃硫酸可以吸收酯化反應中生成的水,降低了生成物濃度使平衡向生成乙酸乙酯的方向移動,
故答案為:AC;濃硫酸可以吸收酯化反應中生成的水,降低了生成物濃度使平衡向生成乙酸乙酯的方向移動;
③乙酸、乙醇易揮發,溫度過高大量乙酸、乙醇未經反應就脫離反應體系,且溫度過高發生其他反應,導致產率降低,
故答案為:大量乙酸、乙醇未經反應就脫離反應體系;溫度過高發生其他反應;
④乙酸乙酯在酸性、堿性條件下均可以發生水解,應選擇中性干燥劑,
故選:B.
點評 本題考查有機物制備實驗、探究實驗,(3)中注意利用控制變量法分析,綜合考查學生實驗能力、分析能力與知識遷移運用能力,難度中等.


科目:高中化學 來源:2016-2017學年安徽師大附中高二上10月月考化學卷(解析版) 題型:選擇題
一 定條件下,用甲烷可以消除氮的氧化物(NOx)的污染,已知:
定條件下,用甲烷可以消除氮的氧化物(NOx)的污染,已知:
①CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160kJ·mol-1;下列選項正確的是
A.CH4(g)+2NO2(g) =N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ
B.CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(l) ΔH3>ΔH1
C.若用0.2mol CH4還原NO2至N2,則反應中放出的熱量一定為173.4kJ
D.若用標準狀況下2.24L CH4還原NO2至N2,整個過程中轉移的電子為0.8mol
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
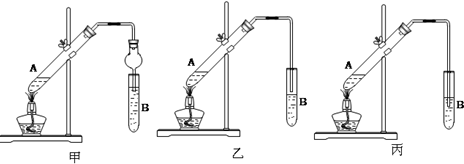
 乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.實驗室利用如圖的裝置制備乙酸乙酯.
乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.實驗室利用如圖的裝置制備乙酸乙酯.| 實驗編號 | 試管Ⅰ中試劑 | 試管Ⅱ中試劑 | 有機層的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 濃硫酸 | 飽和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、鹽酸 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
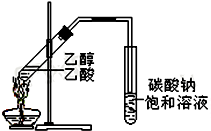 “酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如右圖所示的裝置制取乙酸乙酯.回答下列問題:
“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如右圖所示的裝置制取乙酸乙酯.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 | 分子直徑/nm | 分子與H2O的結合能E/kJ•mol-1 |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
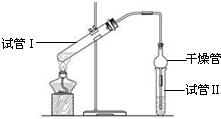
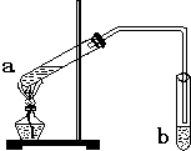 “酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制備,其中a中加乙醇、乙酸和濃硫酸,在試管b中加入7mL飽和碳酸鈉溶液.連接好裝置.用酒精燈對試管a加熱,當觀察到試管b中有明顯現象時停止實驗.回答下列問題:
“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制備,其中a中加乙醇、乙酸和濃硫酸,在試管b中加入7mL飽和碳酸鈉溶液.連接好裝置.用酒精燈對試管a加熱,當觀察到試管b中有明顯現象時停止實驗.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗中,乙烯的用量不會影響該反應的反應焓變△H | |
| B. | 0.5 mol H2O(l) 完全反應放出的熱量為22.9 kJ | |
| C. | 1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和 | |
| D. | 1 mol C2H4(g)和1 mol H2O (g)中化學鍵的總鍵能大于1 mol C2H5OH(g)中化學鍵的總鍵能 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com