
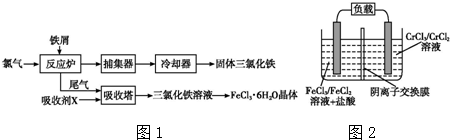
分析 (1)通過工業上制備無水FeCl3的工藝流程圖可知,從反應爐中排出的尾氣是反應剩余的Cl2,與吸收劑X在吸收塔中反應生成FeCl3溶液,則吸收劑X應是FeCl2溶液;
(2)FeCl3溶液滴入50ml沸水中,FeCl3發生水解,再煮沸片刻得紅褐色透明液體,形成氫氧化鐵膠體;膠體粒子的直徑為1~100nm;
(3)根據Fe3+的水解,需先加入鹽酸且保持過量,然后依次進行蒸發濃縮、冷卻結晶、過濾等操作;
(4)H2S氣體通入FeCl3溶液中,Fe3+將H2S氧化為S,Fe3+被還原為Fe2+;
(5)電池工作時,電解質溶液中的陰離子移向負極;充電時,陰極陽離子得到電子發生還原反應;
解答 解:(1)通過工業上制備無水FeCl3的工藝流程圖可知,從反應爐中排出的尾氣是反應剩余的Cl2,與吸收劑X在吸收塔中反應生成FeCl3溶液,則吸收劑X應是FeCl2溶液,
故選:c;
(2)FeCl3溶液滴入50ml沸水中,FeCl3發生水解,再煮沸片刻得紅褐色透明液體,形成氫氧化鐵膠體,該過程可用離子方程式為:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(膠體)+3H+;
故答案為:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(膠體)+3H+;
(3)從FeCl3溶液制得FeCl3•6H2O晶體的過程中,為抑制Fe3+ 的水解,需先加入鹽酸且保持過量,然后依次進行蒸發濃縮、冷卻結晶、過濾等操作;
故答案為:鹽酸;蒸發濃縮;
(4)H2S氣體通入FeCl3溶液中,Fe3+將H2S氧化為S,Fe3+被還原為Fe2+,離子方程式為:H2S+2Fe3+═2Fe2++S↓+2H+;
故答案為:H2S+2Fe3+═2Fe2++S↓+2H+;
(5)電池工作時,電解質溶液中的陰離子移向負極,則鐵鉻氧化還原液流電池放電時,Cl-將移向負極;充電時,陰極陽離子得到電子發生還原反應,Cr3+得電子生成Cr2+,電極反應為:Cr3++e-═Cr2+;
故答案為:負;Cr3++e-═Cr2+.
點評 本題以工業上制備無水FeCl3流程為切入點考查膠體、鹽的水解、實驗基本操作、Fe3+的氧化性、電化學的相關知識,同時考查學生的分析問題和解決問題能力.


科目:高中化學 來源: 題型:實驗題
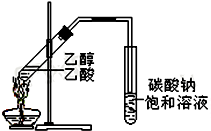 “酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如右圖所示的裝置制取乙酸乙酯.回答下列問題:
“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如右圖所示的裝置制取乙酸乙酯.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H=+244.1kJ/mol | B. | △H=-488.3kJ/mol | C. | △H=-996.6kJ/mol | D. | △H=+996.6kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | C-H | C-F | H-F | F-F |
| 鍵能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +1940 kJ•mol-1 | B. | -1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | +485 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗中,乙烯的用量不會影響該反應的反應焓變△H | |
| B. | 0.5 mol H2O(l) 完全反應放出的熱量為22.9 kJ | |
| C. | 1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和 | |
| D. | 1 mol C2H4(g)和1 mol H2O (g)中化學鍵的總鍵能大于1 mol C2H5OH(g)中化學鍵的總鍵能 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,則H2燃燒熱為241.8 kJ•mol-1 | |
| B. | 從C(石墨,s)═C(金剛石,s)△H=+1.9 kJ/mol,可知:金剛石比石墨更穩定 | |
| C. | 等質量的硫蒸氣和硫固體分別完全燃燒,后者放出熱量更多 | |
| D. | 化學反應中的能量變化,通常表現為熱量的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③④ | B. | ②④ | C. | ①③④ | D. | ①②④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com