
| 化學鍵 | C-H | C-F | H-F | F-F |
| 鍵能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +1940 kJ•mol-1 | B. | -1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | +485 kJ•mol-1 |
 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案科目:高中化學 來源: 題型:解答題
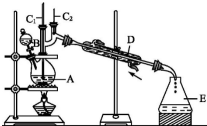 正丁醛是一種化工原料.某實驗小組利用如下裝置合成正丁醛.發生的反應如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
正丁醛是一種化工原料.某實驗小組利用如下裝置合成正丁醛.發生的反應如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO| 沸點/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 物質發生化學變化不一定伴隨著能量變化 | |
| B. | 硫酸鋇、醋酸銨、氨水都是弱電解質 | |
| C. | 向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液變紅色 | |
| D. | 在溫度、壓強一定的條件下,自發反應總是向△H-T△S<0的方向進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
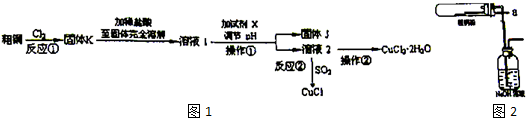
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
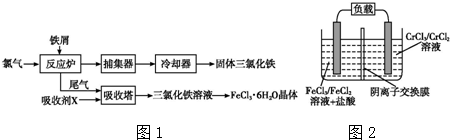
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
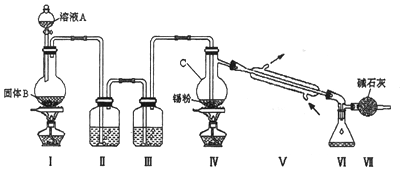
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 少量的CO2通入NaClO溶液中發生反應:NaClO+CO2+H2O=NaHCO3+HClO,說明酸性強弱的順序為H2CO3>HClO>HCO3- | |
| B. | 金剛石是自然界中硬度最大的物質,不可能與氧氣發生反應 | |
| C. | 濃H2SO4具有強氧化性,常溫下就能與金屬Cu發生劇烈反應 | |
| D. | NO2與H2O 反應的過程中,被氧化的氮原子與被還原的氮原子的個數比為1:2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com