
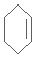
 .
. .
. $\stackrel{Br_{2}/CCl_{4}}{→}$
$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH/C_{2}H_{5}OH}$
$→_{△}^{NaOH/C_{2}H_{5}OH}$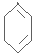 .
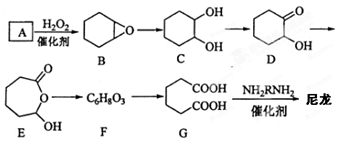
. 分析 化合物A中含碳87.8%,其余為氫,則碳氫原子個數比為:$\frac{0.878}{12}$:$\frac{1-0.878}{1}$=6:10,又知A含有六個碳原子,故A的分子式:C6H10,A結構簡式為 與雙氧水反應生成
與雙氧水反應生成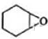 ,
, 與水發生加成反應生成
與水發生加成反應生成 ,
, 發生氧化反應生成
發生氧化反應生成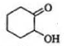 ,
, 再發生氧化反應生成
再發生氧化反應生成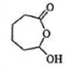 ,
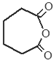
, 再發生氧化反應生成F,F為:
再發生氧化反應生成F,F為: ,
, 再發生氧化反應生成
再發生氧化反應生成 ,
, 與
與 發生縮聚反應生成尼龍,化學式為:
發生縮聚反應生成尼龍,化學式為: ;
;
(6)A和溴發生加成反應生成 ,
, 發生消去反應生成
發生消去反應生成 .
.
解答 解:化合物A中含碳87.8%,其余為氫,則碳氫原子個數比為:$\frac{0.878}{12}$:$\frac{1-0.878}{1}$=6:10,又知A含有六個碳原子,故A的分子式:C6H10,A結構簡式為 與雙氧水反應生成
與雙氧水反應生成 ,
, 與水發生加成反應生成
與水發生加成反應生成 ,
, 發生氧化反應生成
發生氧化反應生成 ,
, 再發生氧化反應生成
再發生氧化反應生成 ,
, 再發生氧化反應生成F,F為:
再發生氧化反應生成F,F為: ,
, 再發生氧化反應生成
再發生氧化反應生成 ,
, 與
與 發生縮聚反應生成尼龍,化學式為:
發生縮聚反應生成尼龍,化學式為: ;
;
(1)A結構簡式為 ,名稱為環己烯,故答案為:環己烯;
,名稱為環己烯,故答案為:環己烯;
(2)C發生氧化反應生成D,故答案為:氧化反應;
(3)通過以上分析知,F為: ,故答案為:
,故答案為: ;
;
(4)核磁共振氫譜個數與氫原子種類相同,氫原子種類越多其核磁共振氫譜個數越多,B的核磁共振氫譜出峰為3,C的核磁共振氫譜出峰為4,D的核磁共振氫譜出峰為6,E的核磁共振氫譜出峰為6,F的核磁共振氫譜出峰為2,所以BCD中核磁共振氫譜個數最多的是D、最少的是B,
故答案為:D;B;
(5)G合成尼龍的方程式為 ,
,
故答案為: ;
;
(6)A和溴發生加成反應生成 ,
, 發生消去反應生成
發生消去反應生成 ,所以其合成路線為
,所以其合成路線為 $\stackrel{Br_{2}/CCl_{4}}{→}$
$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH/C_{2}H_{5}OH}$
$→_{△}^{NaOH/C_{2}H_{5}OH}$ ,
,
故答案為: $\stackrel{Br_{2}/CCl_{4}}{→}$
$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH/C_{2}H_{5}OH}$
$→_{△}^{NaOH/C_{2}H_{5}OH}$ .
.
點評 本題考查有機物的合成,試題側重于學生的分析、推斷、知識綜合運用能力的考查,熟練掌握常見有機物結構與性質為解答關鍵,注意對題目反應信息的理解利用,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 清晨的陽光穿過茂密的林木枝葉所產生的美麗的光線 | |
| B. | 向FeCl3溶液中滴加NaOH溶液出現紅褐色沉淀 | |
| C. | 腎功能衰竭等疾病引起的尿中毒,可利用半透膜進行血液透析 | |
| D. | 在海水與河水交界處,易形成三角洲 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  CH3+Cl2$\stackrel{光照}{→}$ CH3+Cl2$\stackrel{光照}{→}$ CH2Cl+HCl CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$ 2CH3CHO+2H2O | |
| C. | ClCH2═CH2+NaOH$→_{△}^{水}$ HOCH2CH═CH2+NaCl | |
| D. |  +HONO2$→_{△}^{濃硫酸}$ +HONO2$→_{△}^{濃硫酸}$ NO2+H2O NO2+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在同溫同壓時,相同體積的任何氣體單質所含的原子數目相同 | |
| B. | 2 g氫氣所含原子數目為NA | |
| C. | 在常溫常壓下,11.2 L氮氣所含的原子數目為NA | |
| D. | 17 g氨氣所含原子數目為4 NA |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年甘肅省高二上10月月考化學試卷(解析版) 題型:選擇題
現有0.01mol/L的下列溶液:①CH3COOH ②NaHCO3 ③NaHSO4 ④KOH ⑤H2SO4按pH由小到大的順序排列的是 ( )
A.⑤③①②④ B.③⑤① ②④ C.⑤②③①④ D.④②①③⑤
②④ C.⑤②③①④ D.④②①③⑤
查看答案和解析>>
科目:高中化學 來源:2017屆安徽省黃山市高三上月考二化學卷(解析版) 題型:填空題
汽車尾氣中的主要污染物是NO和CO。為減輕大氣污染,人們提出通過以下反應來處理汽車尾氣:
(1 )2NO(g)+2CO(g)
)2NO(g)+2CO(g) 2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(條件為使用催化劑)
2CO2(g)+N2(g)△H=﹣746.5kJ•mol-1(條件為使用催化劑)
已知:2C(s)+O2(g) 2CO(g)△H=﹣221.0kJ•mol-1
2CO(g)△H=﹣221.0kJ•mol-1
C(s)+O2(g) CO2(g)△H=﹣393.5kJ•mol-1
CO2(g)△H=﹣393.5kJ•mol-1
則N2(g)+O2(g)=2NO(g) △H = kJ•mol-1。
(2)T ℃下,在一容積不變的密閉容器中,通入一定量的NO和CO,用氣體傳感器測得不同時間NO和CO的濃度如下表
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
則c2合理的數值為 (填字母標號)。
A.4.20 B.4.00 C.2.95 D.2.80
(3)將不同物質的量的H2O(g)和CO(g)分別通入體積為2 L的恒容密閉容器中,進行反應:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三組數據:
CO2(g)+H2(g),得到如下三組數據:
實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
若a=2,b=1,則c= ,達平衡時實驗組ii中H2O(g)和實驗組iii中CO的轉化率的關系為αii(H2O) αiii(CO)(填“<”、“>”或“=”)。
(4)二甲醚是清潔能源,用CO在催化劑存在下制備二甲醚的反應原理為:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定條件下,該反應中CO的平衡轉化率隨溫度、投料比
CH3OCH3(g)+H2O(g),已知一定條件下,該反應中CO的平衡轉化率隨溫度、投料比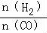 的變化曲線如圖1所示。
的變化曲線如圖1所示。

① a、b、c按從大到小的順序排序為 。
② 根據圖象可以判斷該反應為 反應(填吸熱或放熱)。
(5)CO分析儀的傳感器可測定汽車尾氣是否符合排放標準,該分析儀的工作原理類似于燃料電池 ,其中電解質是氧化釔(Y2O3)和氧化鋯(ZrO2)晶體,能傳導O2-。
,其中電解質是氧化釔(Y2O3)和氧化鋯(ZrO2)晶體,能傳導O2-。
① 負極的電極反應式為 。
② 以上述電池為電源,通過導線連接成圖2。若X、Y為石墨,a為2 L 0.1 mol/L KCl溶液電解一段時間后,取25 mL 上述電解后的溶液,滴加0.4 mol/L醋酸得到圖3曲線(不考慮能量損失和氣體溶于水,溶液體積變化忽略不計)。根據圖2計算,上述電解過程中消耗一氧化碳的質量為 g。
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 前10min反應的平均速率v(C)=0.1 mol/(L•min) | |
| B. | 反應達到平衡時B的平衡濃度是1.5 mol•L-1 | |
| C. | 恒溫下,將反應容器體積壓縮為原來的一半,則D的平衡濃度小于1.0 mol•L-1 | |
| D. | 10 min后在容器中加入A,重新建立平衡時A的轉化率一定大于50% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com