
| A. | 在同溫同壓時,相同體積的任何氣體單質所含的原子數目相同 | |
| B. | 2 g氫氣所含原子數目為NA | |
| C. | 在常溫常壓下,11.2 L氮氣所含的原子數目為NA | |
| D. | 17 g氨氣所含原子數目為4 NA |
分析 A、氣體單質分為單原子分子、雙原子分子和多原子分子;
B、氫氣由氫原子構成;
C、常溫常壓下,氣體摩爾體積大于22.4L/mol;
D、求出氨氣的物質的量,然后根據氨氣中含4個原子來分析.
解答 解:A、氣體單質分為單原子分子、雙原子分子和多原子分子,故同溫同壓下,相同體積的任何氣體單質的物質的量相同,但含有的原子個數不一定相同,故A錯誤;
B、氫氣由氫原子構成,故2g氫氣中含有的氫原子的物質的量為2mol,個數為2NA個,故B錯誤;
C、常溫常壓下,氣體摩爾體積大于22.4L/mol,故11.2L氮氣的物質的量小于0.5mol,則含有的氮原子小于NA個,故C錯誤;
D、17g氨氣的物質的量為1mol,而氨氣中含4個原子,故1mol氨氣中含4NA個原子,故D正確.
故選D.
點評 本題考查了阿伏伽德羅常數的有關計算,掌握物質的量的計算公式和物質結構是解題關鍵,難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | ②⑧ | B. | ①⑥ | C. | ②④ | D. | ③⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | Fe+CuSO4═Cu+FeSO4 | ||
| C. | CaO+H2O═Ca(OH)2 | D. | NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 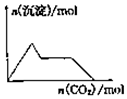 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中緩慢通入CO2至過量 | |
| B. | 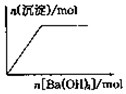 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至過量 | |
| C. | 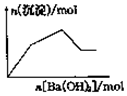 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至過量 | |
| D. | 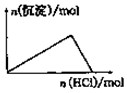 向NaAlO2溶液中逐滴加入鹽酸至過量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
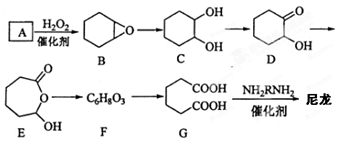
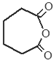 .
. .
.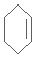 $\stackrel{Br_{2}/CCl_{4}}{→}$
$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH/C_{2}H_{5}OH}$
$→_{△}^{NaOH/C_{2}H_{5}OH}$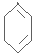 .
.查看答案和解析>>
科目:高中化學 來源:2016-2017學年甘肅省高二上10月月考化學試卷(解析版) 題型:選擇題
相同體積、相同pH的某一元強酸溶液①和某一元弱酸溶液②分別與足量的鋅粉發生反應,下列關于氫氣體積(V)隨時間(t)變化的示意圖正確的是( )
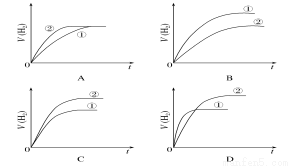
查看答案和解析>>
科目:高中化學 來源:2016-2017學年甘肅省高二上10月月考化學試卷(解析版) 題型:選擇題
從植物花汁中提取的一種有機HIn,可做酸堿指示劑,在水溶液中存在電離平衡:HIn(紅色)  H++In-(黃色),對上述平衡解釋不正確的是
H++In-(黃色),對上述平衡解釋不正確的是
A.升高溫度平衡向正方向移動
B.加入鹽酸后平衡向逆方向移動,溶液顯紅色
C.加入NaOH溶液后平衡向正方向移動,溶液顯黃色
D.加入NaHSO4溶液后平衡向正方向移動,溶液顯黃色
查看答案和解析>>
科目:高中化學 來源:2017屆安徽省黃山市高三上月考二化學卷(解析版) 題型:選擇題
某同學組裝了如圖所示的電化學裝置,其中電極I為Al,其它均為Cu,下列說法正確的是( )
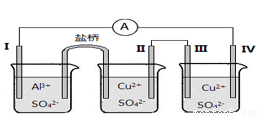
A.裝Al2(SO4)3 溶液的燒杯是原電池,其余兩個為電解(電鍍)池
B.鹽橋中電子從右側流向左側
C.電極II逐漸溶解
D.電極IV的電極反應:Cu2+ + 2e- = Cu
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com