考點:電子式,結構式,電離方程式的書寫,氧化還原反應方程式的配平,離子濃度大小的比較
專題:化學用語專題,氧化還原反應專題
分析:(1)氮氣分子中存在氮氮三鍵,氮原子最外層為8電子;N
2H
4中N原子之間形成1對共用電子對,N原子H原子質量形成1對共用電子對;
(2)根據水的電離方程式書寫液態NH
3電離方程式;
(3)根據硝酸銨溶液中銨離子水解促進了水的電離,氫氧化鈉溶液中氫氧根離子抑制了水的電離判斷;
由于是等體積混合,反應后的溶液可以看做是0.05mol?L
-1NH
4NO
3、0.05mol?L
-1NH
3?H
2O、0.05mol?L
-1NaNO
3,然后根據溶液顯示堿性判斷溶液中各離子濃度大小關系;
(4)依據四個反應的特征,從結合氫離子,結合水中的氫分析判斷;
(5)NH
3和NaClO反應生成N
2H
4、NaCl,根據得失電子守恒和原子守恒來配平方程式.
(6)根據n=
計算32gN
2H
4的物質的量,再根據熱化學方程式書寫原則書寫熱化學方程式;
解答:
解:(1)N
2,氮氣中存在氮氮三鍵,氮原子最外層達到8電子穩定結構,氮氣的電子式為

,
N
2H
4中N原子之間形成1對共用電子對,N原子H原子質量形成1對共用電子對,結構式為

;
故答案為:

;

;
(2)液態NH
3類似H
2O,也能微弱電離且產生電子數相同的兩種離子,根據水的電離方程式書寫液態NH
3電離方程式為:2NH
3?NH
4++NH
2-;
故答案為:2NH
3?NH
4++NH
2-;
(3)硝酸銨溶液中,應用銨離子結合水電離的氫氧根離子,促進了水的電離,而氫氧化鈉溶液中氫氧根離子抑制了水的電離,所以硝酸銨溶液中水的電離程度大于氫氧化鈉溶液中水的電離程度,
由于是等體積混合,反應后的溶液可以看做是0.05mol?L
-1NH
4NO
3、0.05mol?L
-1NH
3?H
2O、0.05mol?L
-1NaNO
3,溶液呈堿性,所以溶液中離子濃度關系為:c(NO
3-)>c(NH
4+)>c(Na
+)>c(OH
-)>c(H
+),
故答案為:大于;c(NO
3-)>c(NH
4+)>c(Na
+)>c(OH
-)>c(H
+);
(4)A、依據反應N
2H
4+H
3O
+═N
2H
5++H
2O 實質是肼結合氫離子反應證明肼具有堿性,故A錯誤;
B、依據反應N
2H
4+H
2O?N
2H
5++OH
-,N
2H
5++H
2O?N
2H
62++OH
-說明肼結合水中的氫離子發生了電離生成了氫氧根離子,故B錯誤;
C、肼結合水中的氫離子發生了電離生成了氫氧根離子,溶液顯堿性且能發生兩步電離,證明肼是二元弱堿,故C正確;
D、肼分子結合水中的氫離子發生了電離生成了氫氧根離子,屬于二元堿,故D錯誤;
故答案為:C;
(5)NH
3和NaClO反應生成N
2H
4、NaCl,NH
3中氮由-3價變成-2價,升高1,NaClO中氯由+1價變成-1,降低2,所以NH
3和NaClO的計量數2:1,然后根據原子守恒,方程為:2NH
3+NaClO=N
2H
4+NaCl+H
2O,
故答案為:2;1;1;1;H
2O;
(6)4gN
2H
4的物質的量為
=
mol,與二氧化氮反應生成氮氣與氣態水放出71kJkJ的熱量,則1mol氣體肼完全燃燒生成氣態水放出的熱量為568kJ,所以該反應的熱化學方程式是:2N
2H
4(g)+2NO
2(g)═3N
2(g)+4H
2O(g)△H=-1136kJ?mol
-1,
故答案為:2N
2H
4(g)+2NO
2(g)=3N
2(g)+2H
2O (g)△H=-1136kJ/mol;
點評:本題主要考查了氮的化合物性質,涉及知識點較多,是一道綜合性較大的題目,培養了學生分析問題、解決問題的能力.

 ,
, ;
; ;
; ;
;

 氯仿(CHCl3)常因保存不慎而被氧化,產生劇毒物光氣(COCl2):2CHCl3+O2→2HCl+2COCl2.下列說法不正確的有( )
氯仿(CHCl3)常因保存不慎而被氧化,產生劇毒物光氣(COCl2):2CHCl3+O2→2HCl+2COCl2.下列說法不正確的有( )

 圖中X、Y、Z、W是地殼含量前四位(不按順序)的元素組成的單質,其它為化合物,A有磁性.它們之間存在如下轉化關系(部分產物已略去).
圖中X、Y、Z、W是地殼含量前四位(不按順序)的元素組成的單質,其它為化合物,A有磁性.它們之間存在如下轉化關系(部分產物已略去).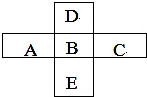 A、B、C、D、E五種主族元素所處周期表的位置如圖所示.
A、B、C、D、E五種主族元素所處周期表的位置如圖所示.