
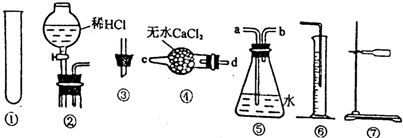
分析 測定Na2CO3樣品中的NaHCO3分解放出的二氧化碳的體積,可將固體混合物放入試管中加熱,生成的二氧化碳氣體用排水法測量體積;
(1)某Na2CO3樣品的純度(其中只含NaHCO3雜質),加熱碳酸氫鈉分解生成碳酸鈉、二氧化碳和水;
(2)實驗裝置中需要酒精燈加熱;氣體流向在裝置④中應從d進c出,裝置⑤是排水量氣需要短進長出,b進a出;
(3)測定Na2CO3樣品中的NaHCO3分解放出的二氧化碳的體積,可將固體混合物放入試管中加熱,生成的二氧化碳氣體用排水法測量體積;測定經實驗一后的固體物質與鹽酸反應放出二氧化碳的體積,應將固體放入試管中,將鹽酸放入分液漏斗中,然后用排水法測量氣體的體積;
(4)當實驗一測得產生的二氧化碳為a L,當實驗二測得產生的二氧化碳為bL,反應的相關方程式為,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,Na2CO3+2HCl═2NaCl+CO2↑+H2O,結合反應的方程式計算;
(5)二氧化碳與水反應生成弱電解質碳酸,碳酸能夠部分電離出碳酸氫根離子,加入的碳酸氫鈉能夠抑制碳酸的電離,則減小了二氧化碳的損失;二氧化碳和碳酸鈉溶液反應生成碳酸氫鈉;
(6)⑥中液體的液面低于⑤中液體的液面,壓強不平衡,待液面平衡后讀取.
解答 解:(1)某Na2CO3樣品的純度(其中只含NaHCO3雜質),加熱碳酸氫鈉分解生成碳酸鈉、二氧化碳和水,反應的化學方程式為:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案為:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)反應應在加熱條件下進行,實驗中缺少酒精燈,實驗裝置中需要酒精燈加熱;氣體流向在裝置④中應從d進c出,裝置⑤是用排水法測量氣體的體積時需要短進長出,b進a出,
故答案為:酒精燈;d;b;
(3)測定經實驗一后的固體物質與鹽酸反應放出二氧化碳的體積,應將固體放入試管中,將鹽酸放入分液漏斗中,然后用排水法測量氣體的體積,應將實驗一連接裝置的順序調整為將①裝置換成②裝置,
故答案為;將①裝置換成②裝置;
(4)當實驗一測得產生的二氧化碳為a L,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
2 1 1
n $\frac{a}{22.4}$mol $\frac{a}{22.4}$mol
則:n=$\frac{a}{11.2}$mol,
則樣品中NaHCO3的質量為:$\frac{a}{11.2}$mol×84g/mol=7.5ag;
當實驗二測得產生的二氧化碳為b L,二氧化碳的物質的量為:$\frac{b}{22.4}$mol,
Na2CO3+2HCl═2NaCl+CO2↑+H2O,
根據分析可知,原混合物中碳酸氫鈉分解后生成的碳酸鈉的物質的量為 $\frac{a}{22.4}$mol,
設原混合物中含有xmolNa2CO3,
則:$\frac{a}{22.4}$+x=$\frac{b}{22.4}$,
整理可得:y=$\frac{b}{22.4}$-$\frac{a}{22.4}$,
則樣品中碳酸鈉的質量為:106($\frac{b}{22.4}$-$\frac{a}{22.4}$)g,NaHCO3的質量為:84g/mol×$\frac{a}{11.2}$mol=7.5ag,
則樣品中碳酸鈉純度的實驗值為=$\frac{106(\frac{b}{22.4}-\frac{a}{22.4})g}{106(\frac{b}{22.4}-\frac{a}{22.4})g+7.5ag}$×100%=$\frac{106(b-a)}{106b+62a}$×100%,
故答案為:7.5ag;$\frac{106(b-a)}{106b+62a}$×100%;
(5)由于CO2與水反應生成碳酸,碳酸能夠電離出碳酸氫根離子和氫離子:CO2+H2O?H2CO3?HCO3-+H+,而NaHCO3電離產生的HCO3-能使上述平衡向著逆向移動,減少了CO2的損失;
不能將⑤中的水改用Na2CO3飽和溶液是因為二氧化碳和碳酸鈉溶液反應生成碳酸氫鈉,反應的離子方程式為:CO32-+CO2+H2O═2HCO3-,
故答案為:因為CO2與水反應,CO2+H2O?H2CO3?HCO3-+H+,NaHCO3電離產生的HCO3-能使上述平衡逆移,減少了CO2的損失;CO32-+CO2+H2O═2HCO3-;
(6)實驗一讀取CO2體積時,⑥中液體的液面低于⑤中液體的液面,但未做任何處理,壓強不平衡,待液面平衡后讀取,此時讀取a值偏小,故答案為:偏小.
點評 本題考查物質的含量測定,為高考常見題型,題目難度較大,明確實驗目的為解答關鍵,試題側重于學生的分析能力、實驗能力和計算能力的考查,注意把握實驗的原理和實驗裝置的連接順序.


科目:高中化學 來源: 題型:多選題
| A. | 控制工業廢水的排放 | B. | 控制生活污水的排放 | ||
| C. | 對被污水污染了的河流進行治理 | D. | 減少用水量 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | SO2氣體通入石蕊試液中,溶液先變紅后褪色 | |
| B. | 在KI-淀粉溶液中通入氯氣,溶液變藍,說明氯氣能與淀粉發生顯色反應 | |
| C. | 標準狀況下,22.4 L任何氣體中都含有6.02×1023個分子 | |
| D. | 濃硝酸在光照條件下變黃,說明濃硝酸不穩定,生成的有色產物能溶于濃硝酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 1 mol Fe溶解于一定量的HN03溶液中,電子轉移數介于2NA和3NA間 | |
| B. | L mol FeCl3完全水解轉化為氫氧化鐵膠體后能生成NA個Fe(OH)3膠粒 | |
| C. | 0.01 mol Mg在空氣中完全燃燒生成MgO和Mg3N2,轉移電子數目為0.02NA | |
| D. | 10 mL 5mol/L (NH4)2S04溶液中含有NH4+數目為0.1NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol過氧化鈉或過氧化鋇跟足量水反應都生成0.5mol氧氣 | |
| B. | 過氧化鋇的化學式是Ba2O2 | |
| C. | 過氧化鋇是離子化合物 | |
| D. | 過氧化鈉和過氧化鋇都是強氧化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應為置換反應 | B. | 每生成1mol O2轉移4mol e- | ||
| C. | H2O2被還原 | D. | 反應后溶液pH值升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
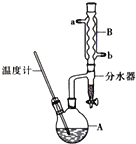 正丁醚常用作有機反應的溶劑.實驗室制備正丁醚的主要實驗裝置如圖:反應物和產物的相關數據如下
正丁醚常用作有機反應的溶劑.實驗室制備正丁醚的主要實驗裝置如圖:反應物和產物的相關數據如下| 相對分 子質量 | 沸點/ ℃ | 密度 (g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 幾乎不溶 |
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O. 查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉跟水的反應:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 次氯酸鈣溶液中通入過量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | 碳酸氫鈣溶液加入過量的氫氧化鈉溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 碳酸氫鈉溶液中加入鹽酸:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com