
分析 (1)凈化除去懸浮雜質,軟化除去水中鈣、鎂離子;
(2)取自江河湖泊中的淡水的處理順序是:先沉淀、再過濾,最后消毒處理;
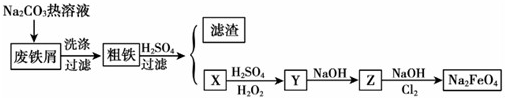
(3)依據流程圖和實驗目的分析判斷,用工業廢鐵屑(含銅、碳、硅等)制取高鐵酸鈉,其中X、Y、Z是含鐵化合物,碳酸鈉溶液水解顯堿性,洗滌廢鐵屑表面油污,油脂在堿性溶液中水解生成溶于水的物質得到粗鐵,加入硫酸,鐵和硫酸反應生成硫酸亞鐵,過濾得到濾渣為銅和硅,濾液為硫酸亞鐵,加入硫酸和過氧化氫氧化亞鐵離子為鐵離子,加入氫氧化鈉用生成氫氧化鐵沉淀,在氫氧化鈉溶液中通入氯氣生成高鐵酸鈉;
①碳酸鈉溶液水解顯堿性清除廢鐵屑表面的油污;
②X為硫酸亞鐵,Y為硫酸鐵,硫酸亞鐵加入過氧化氫和硫酸發生氧化還原反應;
③Z為氫氧化鐵,在氫氧化鈉溶液中氯氣氧化氫氧化鐵為高鐵酸鈉,依據原子守恒和氧化還原反應電子守恒配平書寫化學方程式;
④高鐵酸鈉具有強氧化性能殺菌消毒,在反應過程中被還原為鐵離子在水溶液中水解生成氫氧化鐵膠體,膠體具有吸附懸浮雜質的作用起到凈水作用;
⑤電解時陽極發生氧化反應,鐵失電子生成高鐵酸根離子,依據電解質溶液配平電荷守恒寫出電極反應方程式為Fe+8OH--6e-═FeO42-+4H2O;
(4)c(CO32-)為5.6×10-5mol/L,等體積混合后溶液中c(CO32-)=2.8×10-5mol/L,根據Ksp=c(CO32-)•c(Ca2+)計算沉淀時混合溶液中c(Ca2+),進而計算氫氧根濃度,以此來解答.
解答 解:(1)水的凈化和軟化的區別是水的凈化是用混凝劑將水中的膠體及懸浮物沉淀下來,而水的軟化是除去水中較多的鈣離子和鎂離子,
故答案為:水的凈化是用混凝劑將水中的膠體及懸浮物沉淀下來,而水的軟化是除去水中較多的鈣離子和鎂離子;
(2)生活用水必須保證安全,自來水廠需要對取自江河湖泊中的淡水進行殺菌消毒、混凝沉淀、過濾等工藝處理,這三項處理的正確順序是混凝沉淀→過濾→殺菌消毒,故答案為:混凝沉淀→過濾→殺菌消毒;
(3)依據流程圖和實驗目的分析判斷,用工業廢鐵屑(含銅、碳、硅等)制取高鐵酸鈉,其中X、Y、Z是含鐵化合物,碳酸鈉溶液水解顯堿性,洗滌廢鐵屑表面油污,油脂在堿性溶液中水解生成溶于水的物質得到粗鐵,加入硫酸,鐵和硫酸反應生成硫酸亞鐵,過濾得到濾渣為銅和硅,濾液為硫酸亞鐵,加入硫酸和過氧化氫氧化亞鐵離子為鐵離子,加入氫氧化鈉用生成氫氧化鐵沉淀,在氫氧化鈉溶液中通入氯氣生成高鐵酸鈉;
①碳酸鈉溶液水解顯堿性,洗滌廢鐵屑表面油污,油脂在堿性溶液中水解生成溶于水的物質被洗去;
故答案為:清洗廢鐵屑表面的油污;
②X為硫酸亞鐵,Y為硫酸鐵,硫酸亞鐵中加入過氧化氫在硫酸酸性溶液中發生氧化還原反應,反應生成鐵離子和水,反應的離子方程式為:2Fe2++H2O2+2H+═2Fe3++2H2O;
故答案為:2Fe2++H2O2+2H+═2Fe3++2H2O;
③Z為氫氧化鐵,在氫氧化鈉溶液中氯氣氧化氫氧化鐵為高鐵酸鈉,Cl2將Z為氫氧化鐵氧化為Na2FeO4的化學方程式為:10NaOH+3Cl2+2Fe(OH)3═2Na2FeO4+6NaCl+8H2O;
故答案為:10NaOH+3Cl2+2Fe(OH)3═2Na2FeO4+6NaCl+8H2O;
④Na2FeO4能消毒、凈水的原因是高價鐵具有氧化性,能消毒殺菌,生成Fe3+形成膠體,具有吸附懸浮物的凈水的作用;
故答案為:高鐵酸鹽在殺菌消毒時,本身被還原成Fe3+,Fe3+易水解生成Fe(OH)3,具有膠體的性質,可吸附水中的懸浮雜質,而起到凈化水的作用;
⑤電解時陽極發生氧化反應,電極反應方程式為Fe+8OH--6e-═FeO42-+4H2O;
故答案為:Fe+8OH--6e-═FeO42-+4H2O;
(4)Na2CO3溶液的濃度為5.6×10-5mol/L,等體積混合后溶液中c(CO32-)=$\frac{1}{2}$×5.6×10-5mol/L=2.8×10-5mol/L,根據Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=1×10-4mol/L,原溶液Ca(OH)2溶液的最小濃度為混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小濃度為2×1×10-4mol/L=2×10-4mol/L,氫氧根的最小濃度是4×10-4mol/L,故答案為:4×10-4mol/L.
點評 本題考查了物質制備的實驗過程分析和鐵及其化合物性質的分析應用,電解池原理的分析判斷,綜合性強,難度中等,主要考查學生分析問題的能力,是高考的熱點習題.


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:選擇題
| A. | 加熱蒸餾 | |
| B. | 利用銀鏡反應進行分離 | |
| C. | 加入Na2CO3后,通過萃取的方法分離 | |
| D. | 先加入燒堿溶液,之后蒸餾出乙醛;再加入濃硫酸,蒸餾出乙酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乳酸亞鐵([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一種常用的補鐵劑,可通過乳酸與碳酸亞鐵反應制得:
乳酸亞鐵([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一種常用的補鐵劑,可通過乳酸與碳酸亞鐵反應制得:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ,該分子的核磁共振氫譜有2種峰.
,該分子的核磁共振氫譜有2種峰. .F→G的反應:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.
.F→G的反應:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
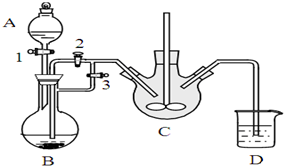
 如圖所示,若錐形瓶內是水,分液漏斗內的液體也是水,向燒杯內滴加水時,發現U形管內液體慢慢右移,恢復到原溫度后液面左邊與右邊基本相平,則燒杯內的物質是( )
如圖所示,若錐形瓶內是水,分液漏斗內的液體也是水,向燒杯內滴加水時,發現U形管內液體慢慢右移,恢復到原溫度后液面左邊與右邊基本相平,則燒杯內的物質是( )| A. | 過氧化鈉 | B. | 氧化鈉 | C. | 鈉 | D. | 鉀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ④⑥ | C. | ②⑤ | D. | ②③ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com