
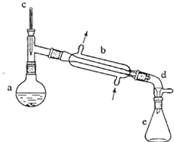
 (醇脫水是合成烯烴的常用方法,實驗室合成環己烯的反應和實驗裝置如下:
(醇脫水是合成烯烴的常用方法,實驗室合成環己烯的反應和實驗裝置如下: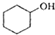 $→_{△}^{濃H_{2}SO_{4}}$
$→_{△}^{濃H_{2}SO_{4}}$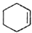 +H2O
+H2O| 相對分子質量 | 密度/(g•cm3) | 沸點/℃ | 溶解性 | |
| 環己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 環己烯 | 82 | 0.8102 | 83 | 難溶于水 |
 .
.分析 (1)根據裝置圖可知裝置b的名稱;
(2)碎瓷片的存在可以防止在加熱過程中產生暴沸現象,補加碎瓷片時需要待已加熱的試液冷卻后再加入;
(3)加熱過程中,環己醇除可發生消去反應生成環己烯外,還可以發生取代反應生成二環己醚;
(4)由于分液漏斗有活塞開關,故使用前需要檢查是否漏液;分液過程中,由于環己烯的密度比水的密度小,故應該從分液漏斗的上口倒出;
(5)無水氯化鈣用于吸收產物中少量的水;
(6)觀察題目提供的實驗裝置圖知蒸餾過程中不可能用到吸濾瓶和球形冷凝器管;
(7)環己醇為0.2mol,根據反應方程式,理論上可以得到0.2mol環己烯,其質量為16.4g,根據產率=$\frac{實際產量}{理論產量}$×100%計算.
解答 解:(1)依據裝置圖分析可知裝置b是蒸餾裝置中的冷凝器裝置,
故答案為:直形冷凝器;
(2)碎瓷片的存在可以防止在加熱過程中產生暴沸現象,補加碎瓷片時需要待已加熱的試液冷卻后再加入,故選B,
故答案為:防止暴沸;B;
(3)加熱過程中,環己醇除可發生消去反應生成環己烯外,還可以發生取代反應,分子間發生脫水反應生成二環己醚為 ,
,
故答案為: ;
;
(4)由于分液漏斗有活塞開關,故使用前需要檢查是否漏液;分液過程中,由于環己烯的密度比水的密度小,故應該從分液漏斗的上口倒出,
故答案為:檢漏;上口倒出;
(5)分離提純過程中加入無水氯化鈣的目的是利用無水氯化鈣吸收產物中少量的水,
故答案為:干燥;
(6)觀察題目提供的實驗裝置圖知蒸餾過程中不可能用到吸濾瓶和球形冷凝器管,
故選CD,
故答案為:CD;
(7)環己醇為0.2mol,理論上可以得到0.2mol環己烯,其質量為16.4g,所以產率=$\frac{10g}{16.4g}$×100%=61%,
故選C,
故答案為:C.
點評 本題考查了物質制備實驗方案設計,醇性質的分析應用,實驗現象和原理的分析判斷,掌握基礎是解題關鍵,題目難度中等.


 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 甲苯(
甲苯(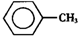 )是一種重要的化工原料,能用于生產苯甲醛(
)是一種重要的化工原料,能用于生產苯甲醛(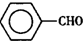 )、苯甲酸(
)、苯甲酸(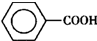 )等產品.下表列出了有關物質的部分物理性質,請回答:
)等產品.下表列出了有關物質的部分物理性質,請回答:| 稱 | 性狀 | 熔點(℃) | 沸點(℃) | 相對密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 無色液體易燃易揮發 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 無色液體 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片狀或針狀晶體 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
 ,此反應的原子利用率理論上可達66.25%.
,此反應的原子利用率理論上可達66.25%.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 0.068 MPa-1 | B. | 0.082 | C. | 0.072 MPa-1 | D. | 0.082 MPa-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 連二亞硫酸鈉(Na2S2O4),又稱保險粉,是印刷工業中重要的還原劑.某課題小組進行如下實驗:
連二亞硫酸鈉(Na2S2O4),又稱保險粉,是印刷工業中重要的還原劑.某課題小組進行如下實驗:| 實驗步驟(不要求寫出具體操作過程) | 預期的實驗現象和結論 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷的燃燒熱△H=-890.3kJ/mol,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| B. | 一定條件下,將0.5molN2和1.5molH2置于密閉容器中充分反應生成NH3放熱akJ,其熱化學方程式為:N2(g)+3H2(g)?2NH3(g)△H=-2akJ/mol | |
| C. | 在101kPa時,2gH2完全燃燒生成液態水,放出285.8kJ熱量,氫氣燃燒的熱化學方程式表示為:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | HCl和NaOH反應的中和熱△H=-57.3kJ/mol,則H2SO4和Ba(OH)2反應的中和熱△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉、鉀著火時,不能用泡沫滅火器滅火 | |
| B. | 氧化鋁是冶煉金屬鋁的原料,也是較好的耐火材料 | |
| C. | 石英是制造光導纖維的原料,也是常用的半導體材料 | |
| D. | 在汽車尾氣系統中裝催化轉化器,可降低尾氣中CO、NOx等的排放量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com