

| A. | 0.068 MPa-1 | B. | 0.082 | C. | 0.072 MPa-1 | D. | 0.082 MPa-1 |
分析 由圖可知,A點乙烯的平衡轉化率為20%,設起始量n(H2O)=n(C2H4)=1mol,轉化的乙烯為0.2mol,則:
C2H4(g)+H2O(g)═C2H5OH(g)
起始量(mol):1 1 0
轉化量(mol):0.2 0.2 0.2
平衡量(mol):0.8 0.8 0.2
壓強之比等于物質的量之比,計算乙烯、水蒸氣、乙醇蒸氣分壓,再根據Kp=$\frac{p({C}_{2}{H}_{5}OH)}{p({C}_{2}{H}_{4})×p({H}_{2}O)}$計算.
解答 解:由圖可知,A點乙烯的平衡轉化率為20%,設起始量n(H2O)=n(C2H4)=1mol,轉化的乙烯為0.2mol,則:
C2H4(g)+H2O(g)═C2H5OH(g)
起始量(mol):1 1 0
轉化量(mol):0.2 0.2 0.2
平衡量(mol):0.8 0.8 0.2
壓強之比等于物質的量之比,則p(C2H4)=p(H2O)=7.8MPa×$\frac{0.8mol}{1.8mol}$=7.8MPa×$\frac{4}{9}$,p(C2H5OH)=7.8MPa×$\frac{1}{9}$,則Kp=$\frac{p({C}_{2}{H}_{5}OH)}{p({C}_{2}{H}_{4})×p({H}_{2}O)}$=$\frac{7.8MPa×\frac{1}{9}}{7.8MPa×\frac{4}{9}×7.8MPa×\frac{4}{9}}$=0.072MPa-1,
故選C.
點評 本題考查化學平衡計算,為高頻考點,側重于學生的分析、計算能力的考查,題目涉及平衡常數計算,答題關鍵是計算各組分反應,注意平衡常數單位問題,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | Cl2、SO2均能品紅溶液褪色,說明二者漂白原理相同 | |
| B. | 濃Na2SO4溶液和甲醛都能使蛋白質從溶液中析出,說明二者均使蛋白質發生鹽析 | |
| C. | CO2、SO2使澄清石灰水變渾濁,說明二者均為酸性氧化物 | |
| D. | 溶液中滴加硝酸酸化的Ba(NO3)2溶液出現白色沉淀,說明該溶液中一定有SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
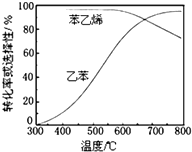 乙苯催化脫氫制苯乙烯反應:
乙苯催化脫氫制苯乙烯反應: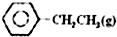 $\stackrel{催化劑}{?}$
$\stackrel{催化劑}{?}$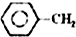 =CH2(g)+H2(g)
=CH2(g)+H2(g)| 化學鍵 | C-H | C-C | C=C | H-H |
| 鍵能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
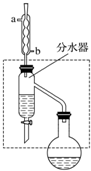 乙酸丁酯是重要的化工原料,具有水果香味.實驗室制備乙酸丁酯的反應、裝置示意圖和有關信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{濃H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O
乙酸丁酯是重要的化工原料,具有水果香味.實驗室制備乙酸丁酯的反應、裝置示意圖和有關信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{濃H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔點/℃ | 16.6 | -89.5 | -73.5 |
| 沸點/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
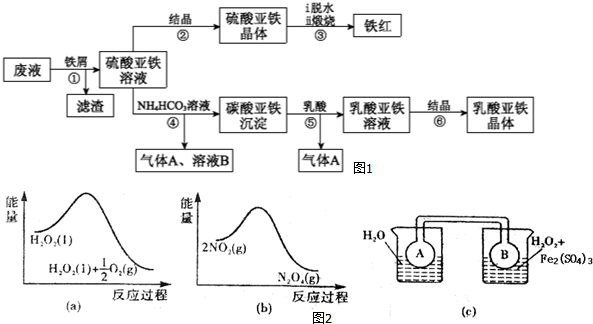
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
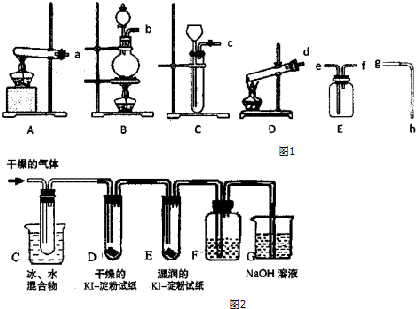
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
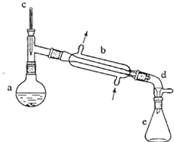 (醇脫水是合成烯烴的常用方法,實驗室合成環己烯的反應和實驗裝置如下:
(醇脫水是合成烯烴的常用方法,實驗室合成環己烯的反應和實驗裝置如下: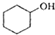 $→_{△}^{濃H_{2}SO_{4}}$
$→_{△}^{濃H_{2}SO_{4}}$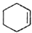 +H2O
+H2O| 相對分子質量 | 密度/(g•cm3) | 沸點/℃ | 溶解性 | |
| 環己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 環己烯 | 82 | 0.8102 | 83 | 難溶于水 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素周期表有7個主族,7個副族,1個零族,1個Ⅷ族,共16縱行 | |
| B. | X2+的核外電子數目為18,則X在第四周期第ⅡA族 | |
| C. | Li是最活潑金屬,F是最活潑非金屬 | |
| D. | NaOH堿性比KOH強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸酸與氫氧化鋇反應 Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 過量CO2通入NaOH溶液中 CO2+OH-=H CO3- | |
| C. | 硝酸銀溶液中加入銅粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 鋅與稀硝酸反應 Zn+2H+═Zn2++H2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com