
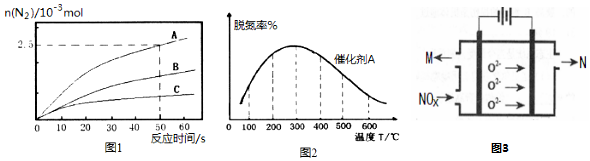
分析 (1)第二步反應②為:N2O2(g)+O2(g)?2NO2,根據蓋斯定律①+②可得:2NO(g)+O2(g)?2NO2(g),總的熱化學方程式-①可得②;
(2)由圖可知300℃以前溫度越高脫氮率越高,300℃后溫度越高脫氮率越低,原因可能是300℃前是平衡的建立過程,而300℃后是平衡的移動,故答案為:300℃之前,溫度升高脫氮率逐漸增大,300℃之后溫度升高脫氮率逐漸減小;300℃前反應未平衡,脫氮率決定于速率,溫度越高速率越快,所以脫氮率增大,300℃之后反應達平衡,脫氮率決定于平衡的移動,該反應正反應是放熱反應,升高溫度平衡逆向移動,脫氮率減小.B催化劑的效率低,所以達平衡的時間長,平衡不移動,但最終的脫氮率不變;
(3)平均組成為NOx的NO、NO2混合氣體,通入足量的NaOH溶液中,充分反應后沒有氣體剩余,根據反應NO+NO2+2NaOH=2NaNO2+H2O和NO2+2NaOH=NaNO2+NaNO3+H2O,說明只有當n(NO2):n(NO)≥1時,混合氣體才能被NaOH溶液完全吸收.當n(NO2):n(NO)=1時,x=1.5;當只有NO2時,x=2;故x取值范圍為1.5≤x<2.NOx被NaOH溶液完全吸收,根據氧化還原反應中,得失電子守恒規律,計算n(NO2-):n(NO3;
(4)電解法處理氮氧化合物原理是將NOx在電解池中分解成無污染的N2和O2除去,兩電極間是固體氧化物電解質,在一定條件下可自由傳導O2-,陰極發生還原反應,陰極上是NOx獲得電子生成N2與O2-.
解答 解:(1)第二步反應②為:N2O2(g)+O2(g)?2NO2,根據蓋斯定律①+②可得:2NO(g)+O2(g)?2NO2(g),總的熱化學方程式-①可得②,則反應②的熱化學方程式為:N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1 ,
故答案為:N2O2(g)+O2(g)?2NO2(g)△H2=△H-△H1;
(2)由圖可知300℃以前溫度越高脫氮率越高,300℃后溫度越高脫氮率越低,原因可能是300℃前是平衡的建立過程,而300℃后是平衡的移動,故答案為:300℃之前,溫度升高脫氮率逐漸增大,300℃之后溫度升高脫氮率逐漸減小;300℃前反應未平衡,脫氮率決定于速率,溫度越高速率越快,所以脫氮率增大,300℃之后反應達平衡,脫氮率決定于平衡的移動,該反應正反應是放熱反應,升高溫度平衡逆向移動,脫氮率減小.B催化劑的效率低,所以達平衡的時間長,平衡不移動,但最終的脫氮率不變,所以圖象為 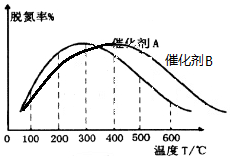 ,
,
故答案為:300℃前反應未平衡,脫氮率決定于速率,溫度越高速率越快,所以脫氮率增大,300℃之后反應達平衡,脫氮率決定于平衡的移動,該反應正反應是放熱反應,升高溫度平衡逆向移動,脫氮率減小; ;
;
(3)平均組成為NOx的NO、NO2混合氣體,通入足量的NaOH溶液中,充分反應后沒有氣體剩余,根據反應NO+NO2+2NaOH=2NaNO2+H2O和NO2+2NaOH=NaNO2+NaNO3+H2O,說明只有當n(NO2):n(NO)≥1時,混合氣體才能被NaOH溶液完全吸收.當n(NO2):n(NO)=1時,x=1.5;當只有NO2時,x=2;故x取值范圍為1.5≤x<2.NOx被NaOH溶液完全吸收,根據氧化還原反應中,得失電子守恒規律,可寫出反應的化學方程式為2NOx+2NaOH=(5-2x)NaNO2+(2x-3)NaNO3+H2O,因此反應后溶液中n(NO2-):n(NO3-)=(5-2x):(2x-3),
故答案為:為1.5≤x<2;(5-2x):(2x-3);
(4)電解法處理氮氧化合物原理是將NOx在電解池中分解成無污染的N2和O2除去,兩電極間是固體氧化物電解質,在一定條件下可自由傳導O2-,陰極發生還原反應,陰極上是NOx獲得電子生成N2與O2-,電極反應式為:2NOx+4xe-=N2+2xO2-,
故答案為:2NOx+4xe-=N2+2xO2-.
點評 本題考查了蓋斯定律,化學平衡的影響因素,化學反應速率的影響因素,氮的化合物,氧化還原反應,電解原理的應用,注意基礎知識的積累,題目難度中等.


 芝麻開花課程新體驗系列答案
芝麻開花課程新體驗系列答案 怎樣學好牛津英語系列答案
怎樣學好牛津英語系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “海水淡化”可以解決淡水供應危機,向海水中加入明礬可以使海水淡化 | |
| B. | 漂白粉解決了氯水漂白時不穩定、難以保存、使用不方便、效果不理想的問題 | |
| C. | 鋼鐵的腐蝕最普遍的是吸氧腐蝕,最終產物為鐵銹 | |
| D. | 溫度、壓強一定時,放熱且熵增的反應能自發進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用含有氯化鈣的融雪劑會加速橋梁的腐蝕 | |
| B. | 近期出現在北方的霧霾是一種分散系,帶活性炭口罩的原理是吸附作用 | |
| C. | 我國部分城市在推廣使用的“甲醇汽油”有降低排放廢氣的優點,無任何負面作用 | |
| D. | 亞硝酸鈉易致癌,但火腿腸中允許含少量的亞硝酸鈉以保持肉質新鮮 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
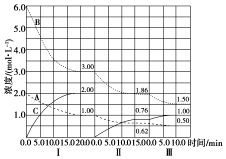 已知某放熱熱反應在1L的密閉容器中進行反應.保持容器體積不變,改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各氣體物質濃度隨時間變化的曲線如圖所示:
已知某放熱熱反應在1L的密閉容器中進行反應.保持容器體積不變,改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各氣體物質濃度隨時間變化的曲線如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a>b>2c | B. | a=b<2c | C. | b=2c=a | D. | b=2c<a |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol氯氣參加氧化還原反應時電子轉移數一定是2NA | |
| B. | 常溫常壓下,56 g Fe與足量的鹽酸完全反應轉移的電子數為3NA | |
| C. | 同溫同壓下,等質量的H2和O2的體積之比是16:1 | |
| D. | 1mol的Na2O2固體中含有離子數為4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.75a% | B. | 1.25a% | C. | 1-1.75a% | D. | 1-1.25a% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com