
分析 (1)反應Cu2S+O2 $\frac{\underline{\;高溫\;}}{\;}$2Cu+SO2中,銅從+1價降為0價,硫從-2價升為+4價,氧從0價降為-2價,根據化合的變化判斷氧化劑;
(2)上述反應中的尾氣主要為二氧化硫,用氨水吸收二氧化硫會生成亞硫酸銨;
(3)用固體FeCl3配制65%FeCl3溶液,要用天平稱取一定時的氯化鐵固體,用量筒量取一定體積的水,在燒中溶解,據此答題;
(4)溶液中的Fe2+遇K3[Fe(CN)6]溶液會呈現特殊的藍色;
(5)鐵離子對雙氧水的分解有催化作用,該步加入雙氧水的目的是氧化亞鐵離子,不引入新雜質,因為溶液中主要是氯化亞鐵,所以也可用氯氣氧化氯化亞鐵,也不會引入雜質,氯氣有毒;
(6)步驟三加入a試劑目的是調節溶液的pH值,使鐵生成氫氧化鐵沉淀,而除去鐵離子,銅離子不能沉淀,所以可以用氧化銅、氫氧化銅等,Fe(OH)3的Ksp=4×10-38;化學上認為殘留在溶液中的離子濃度小于10-5mol/L時,沉淀已完全,所以要使鐵離子沉淀完全時,溶液中的c(OH-)=$\root{3}{\frac{4×10{\;}^{-38}}{1{0}^{-5}}}$=$\root{3}{4}$×10-11,則c(H+)=$\frac{1{0}^{-14}}{\root{3}{4}×1{0}^{-11}}$,所以溶液的pH值為3.2,據此答題;
(7)步驟四為(NH4)2SO3溶液還原氯化銅溶液,得到CuCl產品,同時生成硫酸銨,據此書寫離子方程式;
解答 解:(1)反應Cu2S+O2 $\frac{\underline{\;高溫\;}}{\;}$2Cu+SO2中,銅從+1價降為0價,硫從-2價升為+4價,氧從0價降為-2價,所以氧化劑為,
故答案為:Cu2S、O2;
(2)上述反應中的尾氣主要為二氧化硫,用氨水吸收二氧化硫會生成亞硫酸銨,反應的化學方程式為2NH3+SO2+H2O=(NH4)2SO3,
故答案為:2NH3+SO2+H2O=(NH4)2SO3;
(3)用固體FeCl3配制65%FeCl3溶液,要用天平稱取一定時的氯化鐵固體,用量筒量取一定體積的水,在燒中溶解,用玻璃棒攪拌,故選D;
(4)溶液中的Fe2+遇K3[Fe(CN)6]溶液會呈現特殊的藍色,所以檢驗步驟一之后所得溶液中的Fe2+,可以用K3[Fe(CN)6]溶液,故選C;
(5)鐵離子對雙氧水的分解有催化作用,促使雙氧水分解生成氧氣,該步加入雙氧水的目的是氧化亞鐵離子,不引入新雜質,因為溶液中主要是氯化亞鐵,所以也可用氯氣氧化氯化亞鐵,也不會引入雜質,氯氣有毒,會污染空氣,
故答案為:鐵離子對雙氧水的分解有催化作用,使雙氧水分解生成氧氣;氯氣;氯氣有毒,會污染空氣;
(6)步驟三加入a試劑目的是調節溶液的pH值,使鐵生成氫氧化鐵沉淀,而除去鐵離子,銅離子不能沉淀,所以可以用氧化銅、氫氧化銅等,化學式為CuO、Cu(OH)2,Fe(OH)3的Ksp=4×10-38;化學上認為殘留在溶液中的離子濃度小于10-5mol/L時,沉淀已完全,所以要使鐵離子沉淀完全時,溶液中的c(OH-)=$\root{3}{\frac{4×10{\;}^{-38}}{1{0}^{-5}}}$=$\root{3}{4}$×10-11,則c(H+)=$\frac{1{0}^{-14}}{\root{3}{4}×1{0}^{-11}}$,所以溶液的pH值為3.2,
故答案為:CuO、Cu(OH)2;3.2;
(7)步驟四為(NH4)2SO3溶液還原氯化銅溶液,得到CuCl產品,同時生成硫酸銨,反應的離子方程式為SO32-+2Cu2++2Cl-+H2O=SO4 2-+2CuCl+2H+,
故答案為:SO32-+2Cu2++2Cl-+H2O=SO4 2-+2CuCl+2H+.
點評 本題考查物質制備實驗、對工藝流程分析評價、條件的控制、物質的分離提純等,理解工藝流程原理是解題關鍵,是對學生綜合能力的考查,難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 110 kJ | B. | 440 kJ | C. | 1100 kJ | D. | 2216 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
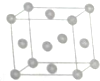 A、B、C、D、M為原子序數依次增大的五種元素,A是元素周期表中原子半徑最小的元素;B的一種單質在自然界中硬度最大;C、D的單質都是空氣的主要成分;M位于元素周期表的第四周期第6縱行.
A、B、C、D、M為原子序數依次增大的五種元素,A是元素周期表中原子半徑最小的元素;B的一種單質在自然界中硬度最大;C、D的單質都是空氣的主要成分;M位于元素周期表的第四周期第6縱行.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化鋁溶液中加入過量氨水反應的實質:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 在加入鋁粉能放出氫氣的溶液中,K+、NO3-、CO32-、Cl-一定能夠大量共存 | |
| C. | 鐵和稀HNO3反應后,溶液pH=2:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 1 L0.1 mol•L-1FeCl3溶液和足量的Zn充分反應,生成11.2 g Fe |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 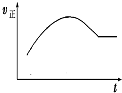 絕熱恒容密閉容器中通入A和B,發生反應:2A (g)+B (g)?2C(g),如圖為其正反應速率隨時間變化的示意圖,則該反應為放熱反應 | |
| B. | 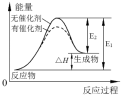 催化劑能降低反應的活化能,提高活化分子的百分含量,從而加快化學反應速率.如圖顯示的是催化反應與無催化反應過程中的能量關系 | |
| C. |  將BaO2放入密閉真空容器中,反應2BaO2(s)?2BaO(s)+O2(g)達到平衡時體系壓強為P,保持溫度不變,t0時刻將容器體積縮小為原來的$\frac{1}{2}$,體系重新達到平衡,體系壓強變化如圖所示 | |
| D. | 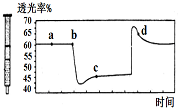 將一定量的NO2充入針筒中后封口,發生反應2NO2 (g)?N2O4(g),如圖表示在拉伸和壓縮針筒活塞的過程中氣體透光率隨時間的變化(氣體顏色越深,透光率越小).則c點與a點相比,c(NO2)增大,c(N2O4)減小. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應混合物中各物質的濃度的改變 | B. | 反應物轉化率的改變 | ||
| C. | 正逆反應速率的改變 | D. | 反應容器中壓強的改變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
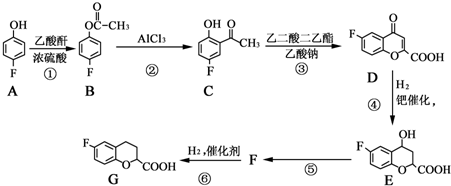
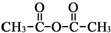
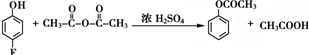 .
.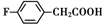 、
、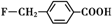
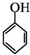 和乙酸酐為原料制備
和乙酸酐為原料制備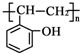 的合成路線流程圖(無機試劑任選).合成路線流程圖示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{濃硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.
的合成路線流程圖(無機試劑任選).合成路線流程圖示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{濃硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com