
分析 (1)4NH3+5O2$\stackrel{催化劑、△}{→}$4NO+6H2O①與4NO+3O2+2H2O→4HNO3②相加得到4NH3+8O2=4HNO3+4H2O,據此計算硝酸的質量分數;
(2)質量轉化為物質的量,依據NH3~HNO3,計算硝酸的物質的量,依據V=$\frac{m}{V}$計算硝酸溶液的密度,依據公式C=$\frac{n}{V}$計算硝酸的物質的量濃度;
(3)鐵與濃硝酸反應生成二氧化氮,與稀硝酸反應生成一氧化氮,當硝酸足量時,反應只生成硝酸鐵,硝酸不足量時生成硝酸亞鐵,依據生成的一氧化氮、二氧化氮的物質的量,消耗鐵的物質的量,利用原子個數守恒、得失電子數守恒計算解答;
(4)①設混合氣體中含有xmolNO,ymolNO2,依據題干條件n(NO):n(NO2)=9:1,及總質量為3160mg,計算兩種氣體的物質的量,
氫氧化鈉與一氧化氮氣體、二氧化氮混合氣體反應,方程式為:NO+NO2+2NaOH=2NaNO2+H2O,反應后剩余氣體為一氧化氮,將剩余其一般氧化為二氧化氮,依據得失電子守恒計算氧化一氧化氮用的氧氣的體積,依據富氧空氣中氧氣的含量計算需要富氧空氣的體積;
②依據得失電子守恒可知NO、NO2中氮原子變為氮氣中0價的N 得到電子總數等于NH3中-3價的N變為氮氣中0價的N失去電子總數,據此解答.
解答 解:(1)4NH3+5O2$\stackrel{催化劑、△}{→}$4NO+6H2O①與4NO+3O2+2H2O→4HNO3②相加得到4NH3+8O2=4HNO3+4H2O,所以硝酸的質量分數為:$\frac{4×63}{4×63+4×18}$=0.78;
故答案為:0.78;
(2)1.70噸液氨的物質的量為:$\frac{1.7×1{0}^{6}}{17}$=0.1×106mol,依據轉化關系4NH3+8O2=4HNO3+4H2O,可知生成的硝酸的物質的量為0.1×106mol;消耗氧氣的物質的量為:0.2×106mol;依據方程式4NH3+8O2=4HNO3+4H2O,可知硝酸溶液的質量=液氨的質量+水的質量+消耗氧氣的質量=1.70×106+4.50×106+×32×0.2×106=12.6×106(g)
該硝酸溶液的體積V=$\frac{m}{ρ}$=$\frac{12.6×1{0}^{6}}{1.31×1{0}^{3}}$=9.62×103(L),則C(HNO3)=$\frac{n}{V}$=$\frac{0.1×1{0}^{6}}{9.62×1{0}^{3}}$=10.40(mol/L);
故答案為:10.40;
(3)鐵與濃硝酸反應生成二氧化氮,與稀硝酸反應生成一氧化氮,當硝酸足量時,反應只生成硝酸鐵,硝酸不足量時生成硝酸亞鐵,設最后溶液中含有硝酸鐵物質的量為xmol,硝酸亞鐵的物質的量為ymol,
則已經得失電子守恒可知鐵生成三價鐵和二價鐵離子失去電子總數等于硝酸還原為二氧化氮和一氧化氮得到電子總數即:3x+2y=0.30mol×(5-4)+0.20mol×(5-2);
依據鐵原子個數守恒可知:x+y=$\frac{22.4}{56}$;
解方程組:3x+2y=0.30mol×(5-4)+0.20mol×(5-2);
x+y=$\frac{22.4}{56}$;
得x=0.1mol,y=0.3mol;
所以最后溶液中含有硝酸鐵,物質的量為0.1mol;含有硝酸亞鐵,物質的量為0.3mol;
故答案為:Fe(NO3)2 0.3mol、Fe(NO3)30.1mol;
(4)①由題意可知:n(NO):n(NO2)=9:1,及總質量為3160mg,設設混合氣體中含有xmolNO,ymolNO2,
則:x:y=9:1;
30x+46y=3.16;
解得x=0.09;y=0.01;
與一氧化氮氣體、二氧化氮混合氣體反應,方程式為:NO+NO2+2NaOH=2NaNO2+H2O,
1 1
0.01mol 0.01mol
剩余NO物質的量為0.09mol-0.01mol=0.08mol,要想完全被吸收,則只需要用氧氣氧化0.04molNO生成0.04mol二氧化氮,依據得失電子守恒得:0.04mol
×(4-2)=n(O2)×4,解得n(O2)=0.02mol,標況下體積為:0.02mol×22.4L/mol=0.448L,
而富氧空氣中O2的體積分數為0.25,所以需要富氧空氣的體積為:0.448L÷0,25=1.792L;
故答案為:1.792L;
②由①知1m3硝酸工業的尾氣中含3160mg NOx,含有NO0.09mol,含有NO20.01mol,如果用氨催化還原法,即用氨作催化劑,將NO、NO2轉化為氮氣直接排入空氣中,設需要氨氣的物質的量為:n(NH3)則依據得失電子守恒可知:0.09mol×(2-0)+0.01mol×(4-0)=n(NH3)×(0-(-3)),
解得n(NH3)=$\frac{0.22}{3}$(mol)
其質量為:$\frac{0.22}{3}$mol×17g/mol=1.25g;
故答案為:1.25.
點評 本題考查了有關方程式的計算,明確方程式中各物質的物質的量的關系及物質的性質是解題關鍵,注意原子個數、得失電子數守恒規律的應用,題目難度較大.


 挑戰100單元檢測試卷系列答案
挑戰100單元檢測試卷系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
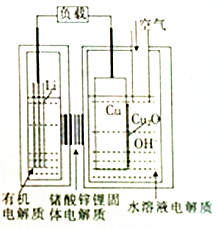 近年來AIST報告正在研究一種“高容量、低成本”鋰-銅空氣燃料電池.該電池通過一種復雜的銅腐蝕“現象”產生電力,其中放電過程為2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列說法不正確的是( )
近年來AIST報告正在研究一種“高容量、低成本”鋰-銅空氣燃料電池.該電池通過一種復雜的銅腐蝕“現象”產生電力,其中放電過程為2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列說法不正確的是( )| A. | 放電時,Li+透過固體電解質向Cu極移動 | |
| B. | 放電時,負極的電極反應式為Cu2O+H2O+2e-=Cu+2OH- | |
| C. | 通空氣時,銅被腐蝕,表面產生Cu2O | |
| D. | 整個反應過程中,銅相當于催化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 焰色反應實驗中,鉑絲在蘸取待測溶液前,應先用稀H2SO4洗凈并灼燒 | |
| B. | 制備氫氧化銅懸濁液時,向10%NaOH溶液中滴入少量2%CuSO4溶液 | |
| C. | 配制濃H2SO4、濃HNO3混合酸時,首先向試管里放入一定量濃H2SO4 | |
| D. | 紙層析實驗中,將試液點滴浸沒在展開劑里,靜置觀察 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | H2S+2NO3-+2H+=2NO2↑+S↓+2H2O | |
| B. | 3 H2S+2NO3-+2H+=2NO↑+3S↓+4H2O | |
| C. | 3Fe3++3NO3-+6H2S=3NO↑+6S↓+3Fe2++6H2O | |
| D. | Fe3++3NO3-+5H2S+2H+=3NO↑+5S↓+Fe2++6H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向l0mL0.1mol•L-1FeI,溶液中緩緩通人標準狀況下11.2mL Cl2 | |
| B. | 向AlCl3溶液中滴加Na2S溶液 | |
| C. | 向含有Na+、Fe2+、Cl-、SO42-離子的溶液中通入NO2 | |
| D. | 向5mL0.1 mol•L-1NaOH溶液中,逐滴加入1 mL0.1 mol•L-1AlCl3溶液,邊滴加邊振蕩 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | L | Z |
| Y | W |
| A. | Y的原子半徑一定比L的大 | |
| B. | 若 X、Y為非金屬元素,則X、Y元素形成的單質晶體類型一定相同 | |
| C. | 若X、W能組成XW2型分子,則其空間構型一定為直線型 | |
| D. | 對應簡單氫化物的沸點可能是 X>Y、Z>W |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 環丙烷的結構簡式可表示為△,而環已烷由于各個原子在空間的排列方式不同,有下列兩種空間異構體.據此判斷,當環已烷的不同碳原子上連有兩個甲基(-CH3)時,包括甲基在六碳環上位置的不同和空間異構體在內,共有異構體的數目是( )
環丙烷的結構簡式可表示為△,而環已烷由于各個原子在空間的排列方式不同,有下列兩種空間異構體.據此判斷,當環已烷的不同碳原子上連有兩個甲基(-CH3)時,包括甲基在六碳環上位置的不同和空間異構體在內,共有異構體的數目是( )| A. | 6種 | B. | 12種 | C. | 14種 | D. | 18種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 非金屬性:A>B>C | B. | 原子序數:A<B<C | ||
| C. | 原子半徑:A<B<C | D. | 單質與氫氣的化合能力:A>B>C |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com