
下列各表述與示意圖一致的是

A.圖①表示向含Mg2+、Al3+、NH4+的鹽溶液中滴加NaOH溶液時,沉淀的量與NaOH的體積的關系圖。則三種離子的物質的量之比為:n(Mg2+):n(Al3+):n( NH4+)=2:3:2
B.圖①中使用的NaOH的濃度為2mol/L
C.圖②中曲線表示某反應過程的能量變化。若使用催化劑,B點會降低
D.圖②中物質A反應生成物質C,△H>0;
C
【解析】
試題分析:A、根據圖中各段含義,得到NaOH溶液為25mL到35mL是與NH4+反應,35mL到40mL是與氫氧化鋁反應,剩余的為氫氧化鎂,故得到n(Mg2+)=0.05mol,根據Al3+與NaOH反應沉淀與溶解時量的關系為3:1確定,與Mg2+反應的NaOH溶液體積為25-5×3=10mL,c(NaOH)=0.05×2÷0.01=10mol/L
根據35mL到40mL段得n(Al3+)=n(NaOH)=0.005×10=0.05mol,
根據25mL到35mL段得n( NH4+)=n(NaOH)=0.01×10=0.1mol
n(Mg2+):n(Al3+):n( NH4+)=0.05mol:0.05mol:0.1mol=1:1:2
本問也可以直接根據25mL到35mL和35mL到40mL兩段判斷出Al3+、NH4+量的關系,確定答案,錯誤;B、錯誤;C、使用催化劑改變反應的活化能,但不能改變反應的焓變,正確;D、物質A反應生成物質C,為放熱反應,△H<0,錯誤。
考點:考查圖像有關問題。


科目:高中化學 來源: 題型:
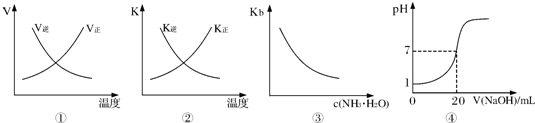
| A、圖①表示反應N2(g)+O2(g)?2NO(g)△H>0正、逆反應的速率隨溫度的變化 | B、圖②表示反應N2(g)+3H2(g)?2NH3(g)△H<0正、逆反應的平衡常數隨溫度的變化 | C、圖③表示氨水的電離平衡常數隨氨水濃度c(NH3?H2O)的變化 | D、圖④表示25℃時,用0.1mol?L-1NaOH溶液滴定20mL 0.lmol?L-1鹽酸,溶液的pH隨加入堿體積的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:
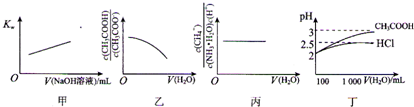
| A、圖甲表示在純水中加入0.01 moL?L-1 NaOH溶液,Kw與NaOH溶液體積變化關系 | ||
B、圖乙表示將1 mol?L-1 CH3COONa溶液加水稀釋,溶液中
| ||
C、圖丙表示0.1mol?L-1 NH3?H2O加水稀釋,溶液中
| ||
| D、圖丁表示100 mL pH=2的HCl和CH3COOH加水稀釋到1000mL時pH變化與水的體積的變化關系 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com