
| A. | Cl2、Al、H2 | B. | F2、K、HCl | C. | NO2、Na、Br2 | D. | HNO3、SO2、H2O |
分析 判斷物質的氧化性和還原性,需從兩個反面入手,1.熟悉物質的性質,2.物質所含元素的化合價,如果物質所含元素處于中間價態,則物質既有氧化性又有還原性,處于最低價,只有還原性,處于最高價,只有氧化性.
解答 解:A、Cl2既有氧化性又有還原性,金屬鋁還原性,氫氣既有氧化性又有還原性,故A錯誤;
B、氟氣只有氧化性,F2化合價只能降低,K化合價只能升高,所以金屬鉀只有還原性,鹽酸和金屬反應表現氧化性,和高錳酸鉀反應表現還原性,故B正確;
C、二氧化氮和水的反應說明二氧化氮既有氧化性又有還原性,金屬鈉只有還原性,溴單質既有氧化性又有還原性,故C錯誤;
D、二氧化硫中硫元素居于中間價,既有氧化性又有還原性,故D錯誤.
故選B.
點評 本題考查了氧化還原反應,主要是對氧化性和還原性的判斷和理解,題目難度不大,側重于基礎知識的考查,注意知識的積累.


 快捷英語周周練系列答案
快捷英語周周練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 納米碳酸鈣材料能夠產生丁達爾效應 | |
| B. | NOx、SO2、PM2.5顆粒都會導致酸雨 | |
| C. | 純堿可用于制造玻璃,也可用于除去物品表面的油污 | |
| D. | 糖類、油脂、蛋白質均能發生水解反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
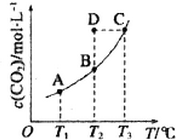 在恒容密閉容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物質的量濃度c(CO2)與溫度T的關系如圖所示.下列說法錯誤的是 ( )
在恒容密閉容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物質的量濃度c(CO2)與溫度T的關系如圖所示.下列說法錯誤的是 ( )| A. | 反應CO(g)+H2O(g)?CO2(g)+H2(g)為吸熱反應 | |
| B. | 在T2時,若反應處于狀態D,則一定有υ正>υ逆 | |
| C. | 平衡狀態A 與C 相-比,平衡狀態A 的c(CO)大 | |
| D. | 若T1、T2 時的平衡常數分別為K1、K2則K1>K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Y2X和Y2X2中化學鍵類型相同,陰、陽離子的個數比相同 | |
| B. | 氣態氫化物的熱穩定性:M>N | |
| C. | M與X的化合物對應的水化物一定是強酸 | |
| D. | 離子半徑r:r(X2-)>(r+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol•L-1NaHC2O4溶液與0.1mol•L-1KOH溶液等體積混合,所得溶液中:c(Na+)>c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-) | |
| B. | 20mL 0.1 mol•L-1 NH4Cl溶液與10mL 0.1mol•L-1NaOH溶液混合后溶液呈堿性,所得溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常溫下,pH=2的HF溶液與pH=12的氫氧化鈉溶液等體積混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| D. | 0.1mol•L-1 NH3•H2O溶液與0.1mol•L-1HNO3等體積混合,所得溶液中:c(H+)>c(OH-)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含大量 H+的溶液中:CrO42-、Cl-、N03-、Na+ | |
| B. | 含大量 A102-的溶液中:Na+、K+、NO3-、HCO3- | |
| C. | 含大量 Al3+的溶液中:K+、Na+、NO3-、Cl0- | |
| D. | 含大量 CH3COO- 的溶液中:NH4+、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2HPO3溶液顯堿性,說明HPO32-的電離程度大于水解程度 | |
| B. | 25℃時,將0.1 mol•L-1的亞磷酸溶液加水稀釋后,n(H+)與n(OH-)的乘積不變 | |
| C. | 利用H3PO3進行化學鍍銀,當參加反應的$\frac{n(A{g}^{+})}{n({H}_{3}P{O}_{3})}$=2時,氧化產物為H3PO4 | |
| D. | NaH2PO3溶液顯酸性,其溶液中存在的粒子濃度關系:c(H2PO3-)>c(HPO32-)>c(H3PO3)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com