
分析 (1)根據三氧化硫濃度變化確定二氧化硫濃度變化,根據平衡的過程中v(SO2)=$\frac{△c}{△t}$來計算;
(2)反應過程中O2的濃度逐漸減小,正反應速率減小,逆反應速率逐漸加快,直到正逆反應速率相等,達到平衡狀態;
(3)反應過程中SO2的濃度逐漸減小,直到達到平整狀態,二氧化硫的濃度不隨時間變化;
(4)可逆反應中,反應物和產物不能完全轉化成產物,具有可逆性,據此判斷.
解答 解:(1)經過10s達到平衡狀態,此時c(SO3)=0.4mol/L,確定二氧化硫濃度變化為:0.4mol/L,v(SO2)=$\frac{△c}{△t}$$\frac{0.4mol/L}{10s}$=0.04mol/(L•s),故答案為:0.04mol/(L•s);
(2)反應過程中O2的濃度逐漸減小,正反應速率減小,逆反應速率逐漸加快,直到正逆反應速率相等,達到平衡狀態,即如圖所示: ;故答案為:
;故答案為: ;
;
(3)反應過程中SO2的濃度逐漸減小,直到達到平整狀態,二氧化硫的濃度不隨時間變化,如圖: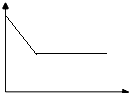 ;故答案為:
;故答案為: .
.
(4)可逆反應中,反應物和產物不能完全轉化成產物,具有可逆性,所以生成的三氧化硫物質的量小于2mol,濃度小于1mol/L,故答案為:不正確.
點評 本題考查學生化學反應速率的計算、反應速率和時間變化曲線以及平衡狀態的建立、可逆反應的特點等知識,難度不大.


科目:高中化學 來源: 題型:多選題
| A. | 鈉原子與氯氣反應生成食鹽后,其結構的穩定性增強 | |
| B. | 第IA族的元素與鹵素結合時,一定形成離子鍵 | |
| C. | 任何單質在離子鍵的形成過程中必定有電子的得與失 | |
| D. | 鈉與氧氣反應生成氧化鈉后,體系的能量降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 定容時俯視容量瓶刻度線,會造成所配溶液濃度偏大 | |
| B. | 移液時不慎有部分液體濺出,會造成所配溶液濃度偏小 | |
| C. | 稱量時托盤上要墊上干凈的稱量紙 | |
| D. | 定容搖勻后發現液面下降,不應再加蒸餾水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2CH4$\stackrel{高溫}{→}$C2H4+2H2 | B. | 2HI+Cl2═I2+2HCl | ||
| C. | C2H5Cl+Cl2$\stackrel{光}{→}$C2H4Cl2+HCl | D. | CH4+2O2$\stackrel{點燃}{→}$CO2+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某學習小組依據反應:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,設計制備磺酰氯(SO2Cl2)的裝置如圖,有關信息如表所示.
某學習小組依據反應:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,設計制備磺酰氯(SO2Cl2)的裝置如圖,有關信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔點 | -54.1 | -101 | -72.4 |
| 沸點 | 69.1 | -34.6 | -10 |
| 性質 | 遇水發生劇烈水解 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com