
| A. | 加入適量的18.4mol/L的硫酸 | B. | 加入幾滴氯化銅溶液 | ||
| C. | 加入適量蒸餾水 | D. | 加入適量的硫酸鈉溶液 |
分析 增大反應物濃度、升高溫度、增大壓強(僅限于有氣體參與的化學反應)、加入催化劑等加快反應速率,但不影響生成氫氣的總量,說明最終酸電離出的氫離子物質的量不變.
解答 解:A.濃硫酸與鋅反應不生成氫氣,故A錯誤;
B.氯化銅和鋅反應生成Cu,Cu、Zn和稀硫酸構成原電池,加快反應速率,硫酸電離出氫離子的物質的量不變,所以生成氫氣的總量不變,故B正確;
C.加水稀釋導致氫離子濃度減小,反應速率降低,故C錯誤;
D.加入適量的硫酸鈉溶液,體積增大,氫離子濃度降低,反應速率減小,故D錯誤.
故選B.
點評 本題考查化學反應速率影響因素,外界條件只影響反應速率但物質性質決定反應速率,知道反應速率的影響有哪些,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 可逆反應“CO(g)+H2O(g)═CO2(g)+H2(g)”中的△H小于0,說明此反應為吸熱反應 | |
| B. | 已知S(s)+O2(g)═SO3(g)的反應熱為△H═-385.5kJ•mol-1,說明硫的燃燒熱為385.5 kJ•mol-1 | |
| C. | 一個化學反應的反應熱等于反應物的總能量減去生成物的總能量 | |
| D. | 化學反應的反應熱只與反應體系的始態和終態有關,而與反應的途徑無關 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向Na2SO4溶液中加入過量BaCl2溶液,則SO42-沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO42- | |
| B. | Ksp小的物質的溶解能力一定比Ksp大的物質的小 | |
| C. | 為減小洗滌過程中固體的損失,最好選用稀H2SO4代替H2O來洗滌BaSO4沉淀 | |
| D. | 洗滌沉淀時,洗滌次數越多越好 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用H2表示的反應速率為0.1 mol/(L•min) | |
| B. | 用NH3表示的反應速率為0.3 mol/(L•min) | |
| C. | 用N2表示的反應速率為0.2mol/(L•min) | |
| D. | 用H2表示的反應速率為0.3 mol/(L•min) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤ | B. | 只有① | C. | ②④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
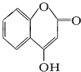 是用來制備抗凝血藥的醫藥中間體,可通過下列路線合成:
是用來制備抗凝血藥的醫藥中間體,可通過下列路線合成:
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二者的分子個數之比為17:16 | B. | 二者的原子個數之比為17:16 | ||
| C. | 二者的氫原子個數之比為17:12 | D. | 在相同條件下二者體積比為17:16 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com