
分析 H2S與O2的反應為:①氧氣不足,硫化氫過量時:2H2S+O2$\frac{\underline{\;點燃\;}}{\;}$2S+2H2O,②氧氣部分過量時:2H2S+O2$\frac{\underline{\;點燃\;}}{\;}$2S+2H2O、S+O2$\frac{\underline{\;點燃\;}}{\;}$SO2,③氧氣有剩余時:2H2S+3O2$\frac{\underline{\;點燃\;}}{\;}$2SO2+2H2O,
根據pV=nRT可知,容積、溫度一定時壓強與物質的量成正比,該溫度下水為氣態,
當只按照反應①進行時,則反應后壓強為反應前的:$\frac{2}{3}$×100%=66.67%<71.4%,當反應按照③進行反應時,則反應后壓強是反應前的:$\frac{4}{5}$×100%=80%>71.4%,說明開始時氧氣不足,反應按照反應①或②進行;
設原混合氣體中含有硫化氫xmol,含有氧氣ymol,
(一)當只發生反應①且恰好反應時,反應后氣體為硫化氫和水,根據反應可知,生成水的體積等于硫化氫的體積,則硫化氫的物質的量為71.4%(x+y),
第二步加入80g氧氣(2.5mol)后主要發生反應:2H2S+3O2$\frac{\underline{\;點燃\;}}{\;}$2SO2+2H2O、S+O2$\frac{\underline{\;點燃\;}}{\;}$SO2,
第一步反應剩余的硫化氫為(x-2y),發生反應后氣體的物質的量減少了:$\frac{1}{2}$(x-2y)mol,根據差量法通入氧氣反應結束后氣體總物質的量增加了:2.5mol-0.5(x-2y)mol=(1.43-71.4%)(x+y)mol,結合x=71.4%(x+y)計算即可;
(二)反應后壓強為反應前的66.67%,而實際上為71.4%,反應②的S+O2$\frac{\underline{\;點燃\;}}{\;}$SO2反應中反應前后氣體體積不變,說明參與該反應的氧氣占有的壓強為:71.4%-66.67%=4.73%,
第二步加入80g氧氣(2.5mol)后主要發生反應:S+O2$\frac{\underline{\;點燃\;}}{\;}$SO2,反應后氣體總體積不變,則加入2.5mol氧氣引起的壓強變化為:1.43-71.4%=0.716,所以該容器中1mol氣體所占有的壓強為:$\frac{0.716}{2.5}$=0.2864,
則反應前硫化氫和氧氣的總物質的量為:$\frac{1}{0.2864}$mol=3.49mol,第一步反應過后過量的氧氣所占的壓強為0.0473,過量的氧氣的物質的量為:$\frac{0.0473}{0.2864}$mol=0.165mol,
硫化氫與氧氣發生反應2H2S+O2$\frac{\underline{\;點燃\;}}{\;}$2S+2H2O的總物質的量為:3.49mol-0.165mol=3.325mol,再結合反應方程式計算出原混合氣體中硫化氫和氧氣的物質的量.
解答 解:硫化氫與氧氣的反應有:①氧氣不足,硫化氫過量時:2H2S+O2$\frac{\underline{\;點燃\;}}{\;}$2S+2H2O,②氧氣部分過量時:2H2S+O2$\frac{\underline{\;點燃\;}}{\;}$2S+2H2O、S+O2$\frac{\underline{\;點燃\;}}{\;}$SO2,③氧氣有剩余時:2H2S+3O2$\frac{\underline{\;點燃\;}}{\;}$2SO2+2H2O,
根據pV=nRT可知,容積、溫度一定時壓強與物質的量成正比,該溫度下水為氣態,
當只按照反應①進行時,則反應后壓強為反應前的:$\frac{2}{3}$×100%=66.67%<71.4%,當反應按照③進行反應時,則反應后壓強是反應前的:$\frac{4}{5}$×100%=80%>71.4%,
說明開始時氧氣不足,反應按照反應①或②進行;
設原混合氣體中含有硫化氫xmol,含有氧氣ymol,
(一)當只發生反應①且恰好反應時,反應后氣體為硫化氫和水,根據反應可知,生成水的體積等于硫化氫的體積,則硫化氫的物質的量為71.4%(x+y),
第二步加入80g氧氣(2.5mol)后主要發生反應:2H2S+3O2$\frac{\underline{\;點燃\;}}{\;}$2SO2+2H2O、S+O2$\frac{\underline{\;點燃\;}}{\;}$SO2,
第一步反應剩余的硫化氫為(x-2y),發生反應后氣體的物質的量減少了:$\frac{1}{2}$(x-2y)mol,根據差量法通入氧氣反應結束后氣體總物質的量增加了:2.5mol-0.5(x-2y)mol=(1.43-71.4%)(x+y)mol,結合x=71.4%(x+y)解得:x=2.27mol、y=0.907mol;
(二)反應后壓強為反應前的66.67%,而實際上為71.4%,反應②的S+O2$\frac{\underline{\;點燃\;}}{\;}$SO2反應中反應前后氣體體積不變,說明參與該反應的氧氣占有的壓強為:71.4%-66.67%=4.73%,
第二步加入80g氧氣(2.5mol)后主要發生反應:S+O2$\frac{\underline{\;點燃\;}}{\;}$SO2,反應后氣體總體積不變,則加入2.5mol氧氣引起的壓強變化為:1.43-71.4%=0.716,
所以該容器中1mol氣體所占有的壓強為:$\frac{0.716}{2.5}$=0.2864,
則反應前硫化氫和氧氣的總物質的量為:$\frac{1}{0.2864}$mol=3.49mol,
第一步反應過后過量的氧氣所占的壓強為0.0473,過量的氧氣的物質的量為:$\frac{0.0473}{0.2864}$mol=0.165mol,
硫化氫與氧氣發生反應2H2S+O2$\frac{\underline{\;點燃\;}}{\;}$2S+2H2O的總物質的量為:3.49mol-0.165mol=3.325mol,其中氧氣的物質的量為:3.326mol×$\frac{1}{3}$=1.108mol,硫化氫的物質的量為:3.326mol×$\frac{2}{3}$=2.217mol,
則原混合氣體中硫化氫的物質的量為:2.217mol,氧氣為:1.108mol+0.165mol=1.273mol,
答:原混合氣體中含有2.27mol硫化氫、0.907mol氧氣或2.217mol硫化氫、1.273mol氧氣.
點評 本題考查了討論法在化學計算中的應用,題目難度較大,明確發生反應原理為解答關鍵,注意掌握討論法在化學計算中的應用方法,試題培養了學生的分析理解能力及化學計算能力.


科目:高中化學 來源: 題型:多選題
| A. | 巴豆酸的官能團是:碳碳雙鍵、羧基 | |
| B. | 純堿溶液、溴水、乙醇、酸高錳酸鉀溶液均可與巴豆酸反應 | |
| C. | 巴豆酸的化學式為C4H6O | |
| D. | 巴豆酸與丁酸互為同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
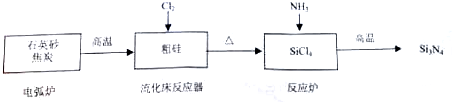
| 物質 | Si | SiCl4 | Cl2 |
| 沸點/℃ | 2355 | 57.6 | -34.1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉是銀白色、有一定延展性的金屬,硬度很大 | |
| B. | 將鈉放在石棉網用酒精燈加熱,鈉劇烈燃燒,產生黃色火焰,生成過氧化鈉 | |
| C. | 金屬鈉在空氣中燃燒,因氧氣濃度低,生成氧化鈉 | |
| D. | 鈉保存在煤油中,也可保存在CCl4中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol Na2O2固體中含有O22- 2NA | |
| B. | 常溫常壓下,3.2g CH4中含有電子2NA | |
| C. | 標準狀況下,11.2L CH3CH2OH中含有分子0.5NA | |
| D. | 100mL 1mol•L-1的CH3COOH溶液中含有CH3COOH分子0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在氧化還原反應中,金屬單質一定是還原劑,非金屬單質一定是氧化劑 | |
| B. | 某元素在化學反應中,由化合態變為游離態,則該元素一定被還原 | |
| C. | 在氧化還原反應中,氧化劑和還原劑可能是同一種物質 | |
| D. | 有單質生成的反應一定是氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10g重水(2H216O)中含有的中子數目為5NA | |
| B. | 28g氮氣所含有的原子數目為NA | |
| C. | 標準狀況下,2.24L水中含有的水分子數目為0.1NA | |
| D. | 1mol鐵與足量稀鹽酸反應轉移的電子數目為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素編號 | 元素性質或原子結構 |
| T | M層的電子數是原子核外電子層數的2倍 |
| X | 原子最外層電子數是次外層的2倍 |
| Y | 常溫下單質為雙原子分子,其氫化物水溶液呈堿性 |
| Z | 元素最高正化合價是+7價 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com