
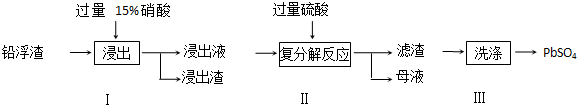
分析 (1)氧化鉛屬于堿性氧化物和硝酸反應生成鹽和水,根據題給信息硝酸把鉛氧化成Pb2+,硝酸被還原成NO,據此寫出方程式;
(2)Pb2+完全轉化成PbSO4沉淀離子濃度小于10-5mol/L,結合溶度積計算;
(3)Pb(NO3)2溶液加硫酸后生成硫酸鉛沉淀和硝酸,過濾得濾液含硝酸;若母液中殘留的SO42-過多,浸出時部分鉛離子生成PbSO4隨浸出渣排出,降低PbSO4的產率;
(4)硫酸鈣微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗滌,除去CaSO4;
(5)充電過程中原電池的負極連接電源負極做電解池的陰極發生還原反應.
解答 解:(1)氧化鉛屬于堿性氧化物和硝酸反應生成鹽和水,根據題給信息硝酸把鉛氧化成Pb2+,硝酸被還原成NO,故反應方程式為PbO+2HNO3=Pb(NO3)2+H2O、3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;
故答案為:PbO+2HNO3=Pb(NO3)2+H2O;3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;
(2)Pb2+完全轉化成PbSO4沉淀離子濃度小于10-5mol/L,Ksp(PbSO4)=1.6×10-8.則c(SO42-)=$\frac{Ksp}{1{0}^{-5}}$=$\frac{1.6×1{0}^{-8}}{1{0}^{-5}}$=1.6×10-3mol/L,
故答案為:1.6×10-3mol/L;
(3)Pb(NO3)2溶液加硫酸后生成硫酸鉛沉淀和硝酸,所以母液可循環利用于步驟I,其溶質主要是HNO3,
若母液中殘留的SO42-過多,浸出時部分鉛離子生成PbSO4隨浸出渣排出,降低PbSO4的產率;
故答案為:HNO3;浸出時部分鉛離子生成PbSO4隨浸出渣排出,降低PbSO4的產率;
(4)硫酸鈣微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗滌,除去CaSO4,離子方程式為:CaSO4+Pb2+=PbSO4+Ca2+,
故答案為:Pb(NO3)2,CaSO4雜質,CaSO4+Pb2+=PbSO4+Ca2+;
(5)充電過程中原電池的負極連接電源負極做電解池的陰極發生還原反應,電極反應為:PbSO4+2e-=Pb+2SO42-,故答案為:PbSO4+2e-=Pb+SO42-.
點評 本題考查了生產硫酸鉛的工藝流程、硝酸的性質等,還涉及基本的實驗操作,考查學生分析問題和解決問題的能力,題目難度中等.


 天天練口算系列答案
天天練口算系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高二上月考一化學試卷(解析版) 題型:選擇題
2012年6月16日我國成功發射了“神州九號”.這標志著中國人的太空時代又前進了一大步.發射“神九”時用肼(N2H4)作為火箭發動機的燃料,NO2為氧化劑,反應生成N2和水蒸氣.已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列關于肼和NO2反應的熱化學方程式中,正確的是
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3 kJ/mol
C.N2H4(g)+NO2(g)=N2(g)+2H2O(l);△H=-1135.7 kJ/mol
D.2N2H 4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol
4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第一電離能:②>③>① | B. | 原子半徑:③>②>① | ||
| C. | 電負性:①>②>③ | D. | 最高正化合價:③>②>① |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 測定某補血劑(成分FeSO4和維生素C)中鐵元素的含量,將一定質量的補血劑溶于水,然后用標準濃度的酸性高錳酸鉀溶液滴定至溶液恰好變紫色且半分鐘不改變 | |
| B. | 測量SO2、N2混合氣體中SO2含量,將標準狀況下一定體積混合氣體通過裝有一定濃度一定體積的碘-淀粉溶液的反應直至溶液藍色恰好消失 | |
| C. | 測定氯化銨與硫酸銨混合物中氯化銨的含量,將一定質量的混合物溶于水,再加入過量氯化鋇溶液至沉淀不再生成,過濾、洗滌、干燥,再稱重 | |
| D. | 測定硫酸銅晶體(CuSO4•xH2O)里結晶水的含量,將一定質量的硫酸銅晶體加熱至藍色變白,冷卻,稱量,重復至前后質量恒定 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com