
| 化學鍵 | C-C | C-H | C一O | Si-Si | Si-H | Si一O |
| 鍵能/(kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
分析 (1)Si原子核外電子數為14,基態原子核外電子排布為1s22s22p63s23p2,據此解答;
(2)硅在自然界中主要以硅酸鹽和二氧化硅形式存在;
(3)硅晶體和金剛石晶體類似都屬于原子晶體,硅原子之間以共價鍵結合.在金剛石晶體的晶胞中,每個面心有一個碳原子(晶體硅類似結構),則面心位置貢獻的原子為 6×$\frac{1}{2}$=3個;
(4)Mg2Si和NH4Cl在液氨介質中反應制得SiH4、NH3和MgCl2;
(5)①鍵能越小,化學鍵越不穩定;
②鍵能越小,化學鍵越不穩定,反應傾向于形成穩定性更強方向進行;
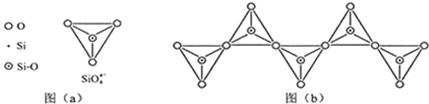
(6)硅酸鹽中的硅酸根(SiO44-)為正四面體結構,所以中心原子Si原子采取了sp3雜化方式;根據圖(b)的一個結構單元中含有1個硅、3個氧原子.
解答 解:(1)Si原子核外電子數為14,基態原子核外電子排布為1s22s22p63s23p2,電子占據的最高能層符號為M,該能層具有的原子軌道數為1+3+5=9、電子數為4,
故答案為:M;9;4;
(2)硅在自然界中主要以硅酸鹽和二氧化硅形式存在;
故答案為:二氧化硅;
(3)硅晶體和金剛石晶體類似都屬于原子晶體,硅原子之間以共價鍵結合.在金剛石晶體的晶胞中,每個面心有一個碳原子(晶體硅類似結構),則面心位置貢獻的原子為 6×$\frac{1}{2}$=3個;
故答案為:3;
(4)Mg2Si和NH4Cl在液氨介質中反應制得SiH4、NH3和MgCl2,反應的化學方程式為:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2;
故答案為:Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2;
(5)①由表中數據可知,C-C鍵和C-H鍵較強,所形成的烷烴穩定.而硅烷中Si-Si鍵和Si-H鍵的鍵能較低,易斷裂,導致長鏈硅烷難以生成,
故答案為:C-C鍵和C-H鍵較強,所形成的烷烴穩定.而硅烷中Si-Si鍵和Si-H鍵的鍵能較低,易斷裂,導致長鏈硅烷難以生成;
②由表中數據可知,C-H鍵的鍵能大于C-O鍵,C-H鍵比C-O鍵穩定.而Si-H鍵的鍵能卻遠小于Si-O鍵,所以Si-H鍵不穩定而傾向于形成穩定性更強的Si-O鍵,
故答案為:C-H鍵的鍵能大于C-O鍵,C-H鍵比C-O鍵穩定.而Si-H鍵的鍵能卻遠小于Si-O鍵,所以Si-H鍵不穩定而傾向于形成穩定性更強的Si-O鍵;
(6)硅酸鹽中的硅酸根(SiO44-)為正四面體結構,所以中心原子Si原子采取了sp3雜化方式;
根據圖(b)的一個結構單元中含有1個硅、3個氧原子;
故答案為:sp3;1:3.
點評 本題主要考查了基態原子的核外電子排布、晶體結構、化學方程式的書寫、雜化軌道,難度中等,解題時注意鍵能對物質性質及結構的影響.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗操作及現象 | 現象的解釋 | |
| A | 將一片鋁箔置于酒精燈外焰上灼燒,鋁箔熔化但不滴落 | 單質鋁的熔點特別高 |
| B | 用玻璃尖嘴導管導出氫氣,點燃,觀察到火焰呈黃色 | 普通玻璃中含有鈉元素 |
| C | 往水中加入Na2O2固體,滴入酚酞呈紅色,振蕩,紅色褪去 | 產生了堿性物質,且Na2O2具有漂白性 |
| D | 向過量的苯酚濃溶液中滴加少許飽和溴水,振蕩,未觀察到白色沉淀產生 | 三溴苯酚溶解在過量的苯酚中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 做衣服的棉和麻均與淀粉互為同分異構體 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的飽和酯類 | |
| C. | 磨豆漿的大豆富含蛋白質,豆漿煮沸后蛋白質變成了氨基酸 | |
| D. | 施肥時,草木灰(有效成分為K2CO3)和NH4Cl混合使用,會產生氨氣降低肥效 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向硫酸鋁溶液中滴加過量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 金屬銅與濃硝酸反應:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 實驗室制備氫氧化鐵膠體:Fe3++3H2O═Fe(OH)3(膠體)+3H+ | |
| D. | 向苯酚鈉溶液中通入少量的二氧化碳氣體:2C6H5ONa+CO2+H2O═2C6H6O+Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 規律 | 結論 |
| A | 非金屬性越強,其氣態氫化物越穩定 | 穩定性:NH3>PH3 |
| B | 反應物濃度越大,反應速率越快 | 常溫下,相同的鐵片中分別加入足量的濃、稀硝酸,濃硝酸中鐵片先溶解完 |
| C | 結構和組成相似的物質,沸點隨相對分子質量增大而升高 | HF沸點低于HCl |
| D | 濃硫酸不能干燥具有還原性的氣體 | 濃硫酸不可以干燥SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com