
分析 (1)反應中HCl→Cl2,氯元素化合價由-1價升高為0價,共升高2價,KMnO4→MnCl2,Mn元素化合價由+7價降低為+2價,共降低5價,化合價升降最小公倍數為10,故KMnO4系數為2,故Cl2系數為5,再根據元素守恒確定其它物質的系數,配平方程式,根據“雙線橋法”標明電子轉移的方向和數目;
(2)化合價降低的元素在反應中被還原,發生還原反應;根據n=$\frac{V}{Vm}$計算氯氣的物質的量,被氧化的HCl為生成Cl2,根據氯元素守恒計算被氧化的HCl,根據方程式計算需要高錳酸鉀的質量,根據氯氣的物質的量計算轉移電子物質的量,再根據N=nNA計算轉移的電子數目.
解答 解:(1)反應中HCl→Cl2,氯元素化合價由-1價升高為0價,共升高2價,KMnO4→MnCl2,Mn元素化合價由+7價降低為+2價,共降低5價,化合價升降最小公倍數為10,故KMnO4系數為2,故Cl2系數為5,根據Mn元素守恒可知MnCl2系數為2,根據K元素守恒可知KCl系數為2,根據Cl元素守恒可知HCl系數為16,根據H元素可知H2O的系數為8,配平后方程式為:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,用“雙線橋法”標明電子轉移的方向和數目為: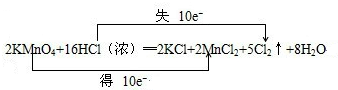 ,
,
故答案為:2、16、2、2、5、8; ;
;
(2)反應中HCl→Cl2,氯元素化合價由HCl中-1價升高為Cl2中0價,Cl2是氧化產物;反應KMnO4→MnCl2,Mn元素化合價由+7價降低為+2價,KMnO4是氧化劑,發生還原反應;560mlCl2的物質的量為$\frac{0.56L}{22.4L/mol}$=0.025mol,被氧化的HCl為生成Cl2,根據氯元素守恒可知被氧化的HCl為0.025mol×2=0.05mol;反應中HCl→Cl2,氯元素化合價由HCl中-1價升高為Cl2中0價,故轉移電子物質的量為0.025mol×2=0.05mol,轉移電子數目為0.05mol×NAmol-1=0.05NA;
故答案為:還原;0.05;0.05NA.
點評 本題考查氧化還原反應配平和基本概念、有關計算等,難度中等,注意掌握氧化還原反應配平常用方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
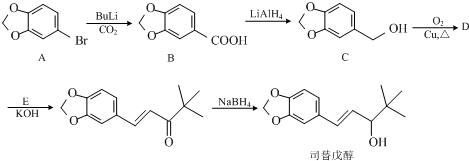
 (任意一種);.
(任意一種);.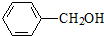 為原料制備
為原料制備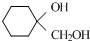 的反應合成路線流程圖(無機試劑任用).
的反應合成路線流程圖(無機試劑任用).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HC1 | B. | 2CH3CH2OH+02$\stackrel{Cu、△}{→}$2CH3CH0+2H20 | ||
| C. | 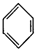 +HNO3$→_{50-60℃}^{濃硫酸}$ +HNO3$→_{50-60℃}^{濃硫酸}$ +H2O +H2O | D. | nCH2=CH2$\stackrel{一定條件}{→}$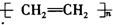 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .
.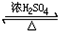 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
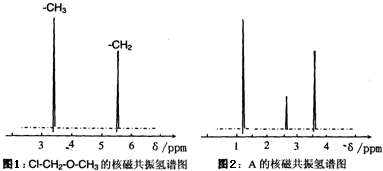
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
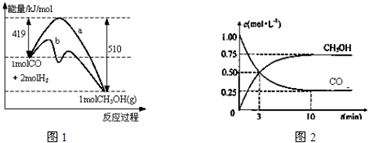
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
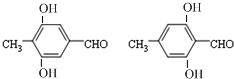
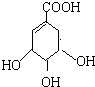 莽草酸是合成治療禽流感的藥物--達菲(Tamiflu)的原料之一.莽草酸是A的一種異構體.A的結構簡式如圖:
莽草酸是合成治療禽流感的藥物--達菲(Tamiflu)的原料之一.莽草酸是A的一種異構體.A的結構簡式如圖: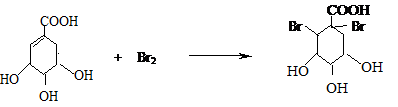 .
.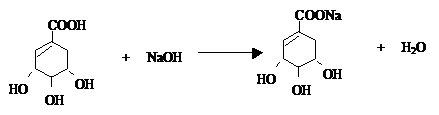 .
.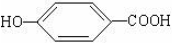 ),其反應類型消去反應.
),其反應類型消去反應.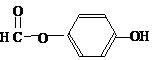 或
或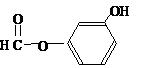 或
或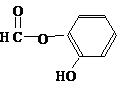 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 偏鋁酸鈉溶液中加過量HCl:AlO2-+4H+=Al3++H2O | |
| C. | 向NH4HSO3溶液中滴入適量NaOH溶液:HSO3-+OH-=SO32-+H2O | |
| D. | 電鍍銅時陽極反應為:Cu2++2e-=Cu |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com