
 將溶液 的c(H+)、c(OH-)之比取為AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃時,用0.01mol.L-1的氫氧化鈉溶液滴定20ml相同物質的量濃度的醋酸溶液,滴定曲線如圖所示.下列有關敘述正確的是( )
將溶液 的c(H+)、c(OH-)之比取為AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃時,用0.01mol.L-1的氫氧化鈉溶液滴定20ml相同物質的量濃度的醋酸溶液,滴定曲線如圖所示.下列有關敘述正確的是( )| A. | A點時c(CH3COO-)>c(Na+) | |
| B. | 室溫時0.01mol.L-1的醋酸溶液pH=6 | |
| C. | OA段溶液中均有:c(CH3COO-)>c(CH3COOH) | |
| D. | 若B點時加入NaOH溶液40mL,所得溶液中:c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+) |
分析 A.A點AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=0,則c(H+)=c(OH-),結合電荷守恒判斷;
B.室溫時0.01mol.L-1的醋酸溶液中AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=6,結合c(H+)×c(OH-)=10-14計算c(H+),再根據pH=-lgc(H+);
C.醋酸為弱電解質,開始階段c(CH3COOH)>c(CH3COO-);
D.若B點時加入NaOH溶液40mL,此時為等濃度CH3COONa、NaOH混合溶液,根據物料守恒:c(Na+)=2c(CH3COO-)+2c(CH3COOH),根據電荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-).
解答 解:A.A點AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=0,則c(H+)=c(OH-),根據電荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),可得c(CH3COO-)=c(Na+),故A錯誤;
B.室溫時0.01mol.L-1的醋酸溶液中AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=6,則$\frac{c({H}^{+})}{c(O{H}^{-})}$=106,而c(H+)×c(OH-)=10-14,聯立可得c(H+)=10-4mol/L,則溶液pH=-lgc(H+)=-lg10-4=4,故B錯誤;
C.醋酸為弱電解質,開始階段如O點c(CH3COOH)>c(CH3COO-),故C錯誤;
D.若B點時加入NaOH溶液40mL,此時為等濃度CH3COONa、NaOH混合溶液,根據物料守恒:c(Na+)=2c(CH3COO-)+2c(CH3COOH),根據電荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),聯立可得:c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+),故D正確.
故選:D.
點評 本題考查離子濃度大小比較、弱電解質的電離、pH有關計算等,關鍵是對AG定義的理解,離子濃度比較中等量關系判斷常涉及電荷守恒、微粒守恒、質子恒等式運用.


科目:高中化學 來源: 題型:解答題
 N2+4NH3;為抑制肼的分解,可采取的合理措施有降低反應溫度(任寫一種).
N2+4NH3;為抑制肼的分解,可采取的合理措施有降低反應溫度(任寫一種).
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AlCl3溶液與燒堿溶液反應,當n(OH-):n(Al3+)=7:2時,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2溶液與NaHS溶液反應,當n(CuCl2):n(NaHS)=1:2時,Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2與FeBr2溶液反應,當n(Cl2):n(FeBr2)=1:1時,2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Fe與稀硝酸反應,當n(Fe):n(HNO3)=1:2時,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
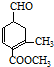 )、乙(
)、乙(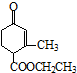 )兩種有機物,下列說法中不正確的是( )
)兩種有機物,下列說法中不正確的是( )| A. | 可用新制的氫氧化銅懸濁液區分這兩種有機物 | |
| B. | 1 mol甲與H2在一定條件下反應,最多消耗3 mol H2 | |
| C. | 甲、乙互為同分異構體 | |
| D. | 等物質的量的甲、乙分別與足量NaOH溶液反應消耗NaOH的量相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
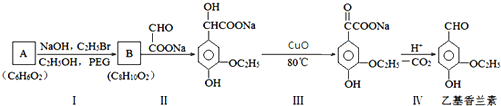
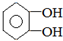 .
.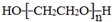 .若PEG的平均相對分子質量為17618,則其平均聚合度約為400.
.若PEG的平均相對分子質量為17618,則其平均聚合度約為400.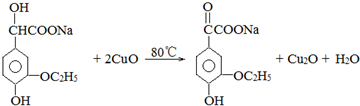 .
.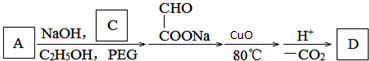
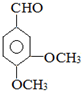 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
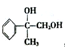 ,G可用作工業增塑劑.回答下列問題:
,G可用作工業增塑劑.回答下列問題: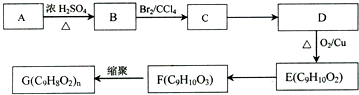
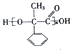 ,已知A的一種同分異構體也能轉化為B,則該同分異構體的結構簡式為
,已知A的一種同分異構體也能轉化為B,則該同分異構體的結構簡式為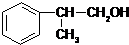 .
.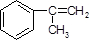 +Br2→
+Br2→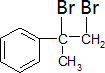 .
.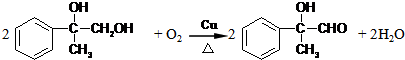 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 反應Ⅰ的離子方程式為2OH-+Al2O3═2AlO2-+H2O | |
| B. | 操作a的內容包括:通入過量CO2、過濾、洗滌、灼燒 | |
| C. | 操作b為電解熔融狀態的Al2O3或用CO還原Al2O3 | |
| D. | 固體b灼燒后與鋁反應可用于工業上冶煉相應的金屬 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
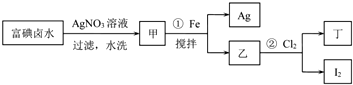
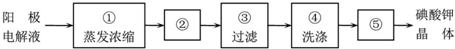
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
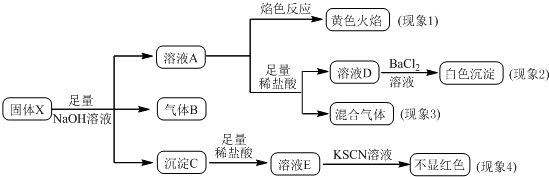
| A. | 根據現象1可推出該固體粉末中一定含有NaNO3 | |
| B. | 根據現象2可推出該固體粉末中一定含有K2SO4 | |
| C. | 根據現象3可推出該固體粉末中一定含有K2SO3 | |
| D. | 根據現象4可推出該固體粉末中一定沒有Fe2O3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com