
| A. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{1}$ | B. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{4}{1}$ | C. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{4}$ | D. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{3}{2}$ |
分析 鋅與濃硫酸發生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,隨著反應的進行,硫酸濃度降低,發生:Zn+H2SO4=ZnSO4+H2↑,生成氣體為SO2和H2的混合物,物質的量為$\frac{26.88L}{22.4L/mol}$=1.2mol,剩余硫酸的物質的量為:n(H2SO4)剩=$\frac{1}{2}$×0.1L×1mol/L=0.05mol,
消耗硫酸的物質的量為:n(H2SO4)消耗=0.1L×18.5mol/L-0.05mol=1.8mol,根據反應的化學方程式計算.
解答 解:n(H2SO4)濃=0.1L×18.5mol/L=1.85mol,
剩余硫酸的物質的量為:n(H2SO4)剩=$\frac{1}{2}$×1L×0.1mol/L=0.05mol,
消耗硫酸的物質的量為:n(H2SO4)消耗=1.85mol-0.05mol=1.8mol,
鋅與濃硫酸發生:Zn+2H2SO4=ZnSO4+SO2↑+H2O,隨著反應的進行,硫酸濃度降低,發生:Zn+H2SO4=ZnSO4+H2↑,
生成氣體為SO2和H2的混合物,物質的量為$\frac{26.88L}{22.4L/mol}$=1.2mol,
設混合物氣體中含有xmolSO2,ymolH2,
Zn+2H2SO4=ZnSO4+SO2↑+H2O
2xmol xmol
Zn+H2SO4=ZnSO4+H2↑
ymol ymol
則有:x+y=1.2mol ①
2x+y=1.8mol ②
解得:x=0.6mol y=0.6mol
所以n(SO2):n(H2)=x:y=0.6:0.6=1:1
故選A.
點評 本題考查化學方程式的計算,題目難度中等,本題注意以下幾點:①濃硫酸與鋅反應生成SO2,②隨著反應的進行,硫酸的濃度降低,與鋅反應生成H2,③根據反應的方程式利用守恒的方法列式計算.


 優百分課時互動系列答案
優百分課時互動系列答案 開心蛙狀元作業系列答案
開心蛙狀元作業系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
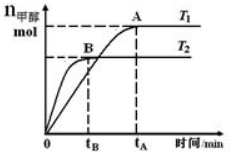 在恒容密閉容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他條件不變的情況下,研究溫度對反應的影響,實驗結果如圖所示.下列說法正確的是( )
在恒容密閉容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他條件不變的情況下,研究溫度對反應的影響,實驗結果如圖所示.下列說法正確的是( )| A. | CO合成甲醇的反應為吸熱反應 | |
| B. | 該反應在T1時的平衡常數比T2時的大 | |
| C. | 平衡常數K=$\frac{c(CO)•{c}^{2}({H}_{2})}{c(C{H}_{2}OH)}$ | |
| D. | 處于A點的反應體系從T1變到T2,達到平衡時$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強酸性溶液中:Na+、CO32-、NH4+、NO3- | |
| B. | 無色溶液中:Cl-、H+、Cu2+、SO42- | |
| C. | 使石蕊試液變藍的溶液中:CO32-、Na+、MnO4-、K+ | |
| D. | 含SCN-的溶液中:K+、NH4+、Cl-、Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
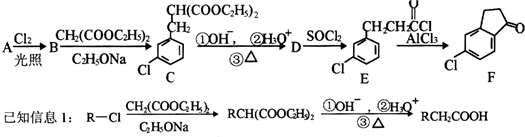
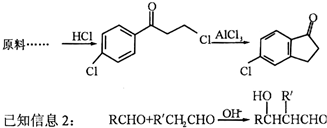
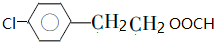 .
.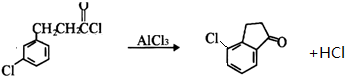 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(A)=0.3 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1 mol/(L•min) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖為實驗室某濃鹽酸試劑瓶上的標簽,試根據有關數據回答下列問題:
如圖為實驗室某濃鹽酸試劑瓶上的標簽,試根據有關數據回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com