
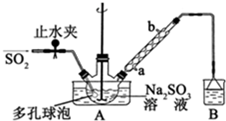
分析 (1)甲醛易溶于水,二氧化硫為酸性氧化物,有刺激性氣味且有毒,能和堿反應;冷凝管中冷卻水采用逆流的方法;
(2)反應物接觸面積越大反應速率越快;
(3)根據反應物、生成物和反應條件書寫方程式;
(4)NaHSO2•HCHO•2H2O不穩定,易被氧氣氧化;
(5)NaHSO2•HCHO•2H2O能被碘氧化生成硫酸根離子,同時碘被還原生成碘離子,硫酸根離子能和氯化鋇反應生成硫酸鋇白色沉淀;
①生成的硫酸鋇沉淀可能吸附有氯離子,用硝酸酸化的硝酸銀檢驗氯離子;
②根據S原子守恒得NaHSO2•HCHO•2H2O---SO42----BaSO4,根據該關系式計算樣品純度.
解答 解:(1)甲醛易溶于水,二氧化硫為酸性氧化物,有刺激性氣味且有毒,不能直接排空,但能和堿反應生成無毒物質,所以B中溶液應該是NaOH溶液,吸收未反應的二氧化硫和甲醛;冷凝管中冷卻水采用逆流的方法,所以b是出口、a是進口,故答案為:NaOH溶液;a;
(2)反應物接觸面積越大反應速率越快,A中多孔球泡能增大反應物接觸面積,從而提高反應速率,故答案為:增大氣體與溶液的接觸面積,加快氣體的吸收速率;
(3)根據反應物、生成物和反應條件書寫方程式為NaHSO3+HCHO+Zn+H2O$\frac{\underline{\;80-90℃\;}}{\;}$NaHSO2•HCHO+Zn(OH)2,故答案為:NaHSO3+HCHO+Zn+H2O$\frac{\underline{\;80-90℃\;}}{\;}$NaHSO2•HCHO+Zn(OH)2;
(4)NaHSO2•HCHO•2H2O不穩定,易被氧氣氧化,為防止被氧氣氧化,所以步驟3中在真空容器中蒸發濃縮,故答案為:氧氣將產物氧化;
(5)NaHSO2•HCHO•2H2O能被碘氧化生成硫酸根離子,同時碘被還原生成碘離子,硫酸根離子能和氯化鋇反應生成硫酸鋇白色沉淀;
①生成的硫酸鋇沉淀可能吸附有氯離子,用硝酸酸化的硝酸銀檢驗氯離子,其檢驗方法是取最后一次洗滌液少許于試管中,滴加HNO3酸化的AgNO3溶液,若無白色沉淀,說明已經洗凈,若有白色沉淀,則未洗凈,故答案為:取最后一次洗滌液少許于試管中,滴加HNO3酸化的AgNO3溶液,若無白色沉淀,說明已經洗凈,若有白色沉淀,則未洗凈;
②根據S原子守恒得NaHSO2•HCHO•2H2O---SO42----BaSO4,n(BaSO4)=$\frac{0.466g}{233g/mol}$=0.002mol,根據原子守恒知,20.00mL配制的溶液中含有n(NaHSO2•HCHO•2H2O)=n(BaSO4)=0.002mol,則100mL該溶液中含有n(NaHSO2•HCHO•2H2O)=0.002mol×5=0.01mol,m(NaHSO2•HCHO•2H2O)=0.01mol×154g/mol=1.54g,
樣品純度=$\frac{1.54g}{2.0g}$×100%=77%,
故答案為:77%.
點評 本題考查物質制備,為高頻考點,側重考查學生實驗操作、實驗評價及化學基本計算,明確實驗原理、物質性質、實驗操作規范性是解本題關鍵,注意(1)中冷凝管水流方向,為易錯點.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  由如圖知,石墨轉變為金剛石是放熱反應 | |
| B. |  由如圖知,S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2則△H1<△H2 | |
| C. |  由如圖知,白磷比紅磷穩定 | |
| D. |  如由圖知,CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
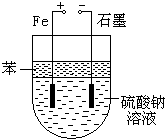 實驗室用NaOH和FeSO4制取Fe(OH)2時,Fe(OH)2很容易被氧化,若采用如圖所示裝置制取,可以得到較純凈的Fe(OH)2.
實驗室用NaOH和FeSO4制取Fe(OH)2時,Fe(OH)2很容易被氧化,若采用如圖所示裝置制取,可以得到較純凈的Fe(OH)2.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | N≡O | Cl-Cl | Cl-N | N=O |
| 鍵能/kJ.mol-1 | 630 | 243 | a | 607 |
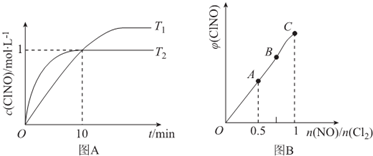
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 以煤為原料,經過化學加工使煤轉化為氣體、液體、固體燃料以及各種化工產品的工業叫煤化工.
以煤為原料,經過化學加工使煤轉化為氣體、液體、固體燃料以及各種化工產品的工業叫煤化工.| 起始 濃度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用萃取方法用四氯化碳提取溴水中的溴單質 | |
| B. | 利用蒸餾的方法可以分離沸點相差較大的液體混合物 | |
| C. | 利用分液的方法分離酒精和水 | |
| D. | 利用結晶的方法除去KNO3中的氯化鉀 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com