

 .
. 分析 (1)①根據蓋斯定律書寫目標熱化學方程式;
②由電池裝置圖可知,Cu上二氧化碳得電子生成甲烷;根據酸的揮發性分析;
③計算平衡時氫氣濃度變化量,利用三段式計算平衡時各組分濃度,代入平衡常數表達式計算;
(2)NH4HS中硫元素為-2價,具有還原性能被氧氣氧化為硫單質;
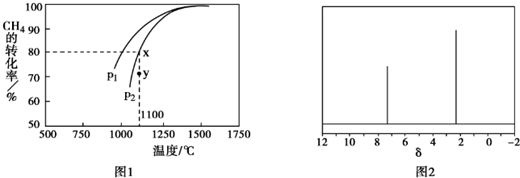
(3)該反應正向為體積增大的方向,壓強越大,CH4的轉化率越小;壓強為P2時,在Y點反應未達到平衡,則反應正向移動;
(4)已知X的相對分子質量為l06,設其分子式為CxHy,由$\frac{106}{12}$可知x=8,y=10,再根據質譜圖中有2個峰,判斷分子中含有2種環境的H.
解答 解:(1)①已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根據蓋斯定律,②+③-①×2得:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162kJ•mol-1,
故答案為:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162kJ•mol-1;
②由電池裝置圖可知,Cu上二氧化碳得電子生成甲烷,則Cu電極上的電極反應為:CO2+8e-+8H+=CH4+2H2O;可向裝置中加入少量的酸作電解質,由于鹽酸易揮發,生成的甲烷中會混有HCl氣體,所以選用硫酸,不用鹽酸;
故答案為:CO2+8e-+8H+=CH4+2H2O;硫酸;
③平衡時H2的轉化率為80%,參加反應氫氣的物質的量=0.3mol×80%=0.24mol,故氫氣的濃度變化量=$\frac{0.24mol}{10L}$=0.024mol/L,則:
CO(g)+3H2(g)?CH4(g)+H2O(g)
開始(mol/L):0.01 0.03 0 0
變化(mol/L):0.008 0.024 0.008 0.008
平衡(mol/L):0.002 0.006 0.008 0.008
故平衡常數=$\frac{0.008×0.008}{0.002×0.00{6}^{3}}$=1.5×105,
故答案為:1.5×105;
(2)NH4HS中硫元素為-2價,具有還原性能被氧氣氧化為硫單質,則一定條件下向NH4HS溶液中通入空氣,得到單質硫和氨水,則反應方程式為:2NH4HS+O2=2NH3•H2O+2S↓;
故答案為:2NH4HS+O2=2NH3•H2O+2S↓;
(3)該反應正向為體積增大的方向,壓強越大,CH4的轉化率越小,已知相同溫度下,P1條件下的轉化率大于P2,則P1小于P2;壓強為P2時,在Y點反應未達到平衡,則反應正向移動,所以v(正)大于v(逆);
故答案為:小于;大于;
(4)芳香烴X,已知X的相對分子質量為l06,設其分子式為CxHy,由$\frac{106}{12}$可知x=8,y=10,說明分子中含有一個苯環,另外含有2個C原子,再根據質譜圖中有2個峰,可知分子中含有2種環境的H,則分子結構對稱,所以其結構簡式為 ,故答案為:
,故答案為: .
.
點評 本題考查了蓋斯定律、原電池原理、方程式的書寫、化學平衡常數、平衡移動、有機物分子式的確定等,題目涉及的知識點較多,側重于考查學生對基礎知識的綜合應用能力,題目難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=0.2 mol•L-1•min-1 | ||
| C. | v(H2)=0.2 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (NH4)2SO3 | B. | NH4Cl | C. | (NH4)2CO3 | D. | (NH4)3PO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 學生設計了下圖所示的方法對A鹽進行鑒定
學生設計了下圖所示的方法對A鹽進行鑒定| A. | A中一定有Fe3+ | B. | C中一定有Cu2+ | ||
| C. | B一定為AgCl沉淀 | D. | A一定為CuCl2溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=6的溶液 | B. | 能與金屬Al反應放出H2的溶液 | ||
| C. | 遇酚酞顯無色的溶液 | D. | c(H+)>c(OH-)的溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應中共轉移3 mol電子 | B. | 反應中共消耗1.8 mol H2SO4 | ||
| C. | 反應中共消耗97.5 g Zn | D. | 氣體甲中SO2與H2的體積比為4:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com