
| A. | (NH4)2SO3 | B. | NH4Cl | C. | (NH4)2CO3 | D. | (NH4)3PO4 |
分析 由于白色化合物與堿溶液反應產生使酚酞試液變紅色的氣體,所以該物質屬于銨鹽;又該溶液用硝酸酸化后,再加入氯化鋇溶液時,能生成沉淀,所以產生的沉淀為硫酸鋇,故對應的陰離子可以是硫酸根離子,也可以是亞硫酸根離子.
解答 解:由于白色化合物與堿溶液反應產生使酚酞試液變紅色的氣體,所以該物質屬于銨鹽,又該溶液用硝酸酸化后,再加入氯化鋇溶液時,能生成沉淀,NH4Cl、(NH4)2CO3、(NH4)3PO4 不能生成沉淀,所以產生的沉淀為硫酸鋇,故對應的陰離子可以是硫酸根離子,也可以是亞硫酸根離子,則X為選項中的(NH4)2SO3;
故選A.
點評 本題考查了銨鹽性質、亞硫酸根離子的還原性,掌握離子性質是解題的關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | +8QkJ/mol | B. | +16Q kJ/mol | C. | -8Q kJ/mol | D. | -16Q kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
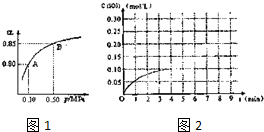
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 編號 | 電極材料 | 電解質溶液 | 電流計指針偏轉方向 |
| 1 | Mg Al | 稀鹽酸 | 偏向Al |
| 2 | Al Cu | 稀鹽酸 | 偏向Cu |
| 3 | Al 石墨 | 稀鹽酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Cu | 濃硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

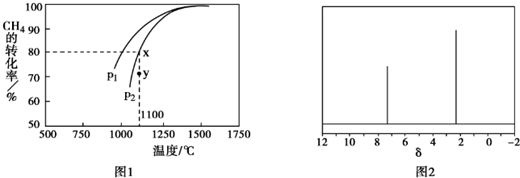
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容量瓶、分液漏斗、滴定管在使用府前都需要檢杏是否漏水,可以用相同的方法檢查是否漏水 | |
| B. | 溶液蒸發操作時蒸發皿中液體的量不能超過容積的1/2 | |
| C. | 強酸滴定強堿時,用酚酞指示劑比用甲基橙更易判斷滴定終點 | |
| D. | 物質的分離提純方法之一為“篩分”:如膠體一半透膜法分離提純;懸濁液一過濾分離,本質上就是依椐所分離粒子的直徑大小選擇具有合適孔徑的“篩子” |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | L | M | Q | R | T |
| 原子半徑/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合價 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氫化物的還原性為H2T>H2R | |
| B. | 單質與稀鹽酸反應的速率為L<Q | |
| C. | L、M、R的最高價氧化物的水化物兩兩之間均能反應 | |
| D. | 離子半徑:L2+<R2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知:O═O鍵鍵能為a kJ/mol、H-H鍵鍵能為b kJ/mol、水蒸氣中H-O鍵能為c kJ/mol.又知:H2O(g)═H2O(l)△H=-d kJ/mol.則反應2H2 (g)+O2(g)═2H2O(l) 的△H為:(a+2b-4c-2d)kJ/mol | |
| B. | 為確定某酸H2A是強酸還是弱酸,可測常溫下NaHA溶液的pH.若常溫下pH>7,則H2A是弱酸;若pH<7,則H2A是強酸 | |
| C. | 常溫下pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,則溶液濃度大小關系:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa)>c(NaOH) | |
| D. | 相同溫度下,將足量氯化銀固體分別放入相同體積的①蒸餾水、②0.1 mol/L鹽酸、③0.1 mol/L氯化鎂溶液、④0.1 mol/L硝酸銀溶液中,Ag+濃度:①>④=②>③ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com